Реферат: Геометрія молекул
б) молекули типу АХ3 Е (є одна неподілена пара електронів) мають пірамідальну форму, наприклад, NH3 :
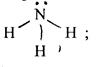 (5)
(5)
в) молекули типу АХ2 Е2 (з двома неподіленими парами) мають кутову форму, причому неподілені пари електронів направлені до вершин тетраедра, наприклад, Н2 О:
![]() (6)
(6)
5-електронні пари:
а) молекули типу АХ5 мають тригонально-біпірамідальну конфігурацію, наприклад, PCl5 :
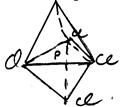 (7)
(7)
б) молекули типу АХ4 Е теж мають тригонально-біпірамідальну конфігурацію, в якій місце одного атома займає неподілена пара електронів, при цьому можливі два нееквівалентні положення цієї пари: неподілена електронна пара в екваторіальній площині біпіраміди, або направлена у одну з вершин біпіраміди.
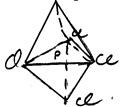
Встановлено, що неподілені пари розміщені в екваторіальній площині, тому молекули типу АХ4 Е мають конфігурацію спотвореного тетраедра або дисфоноїда. Наприклад, TeCl4 :
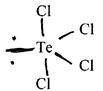 (8)
(8)
в) в молекулах типу АХ3 Е2 обидві неподілені пари електронів розташовані в екваторіальній площині і молекула має Т-подібну форму. Наприклад, ClF3 :
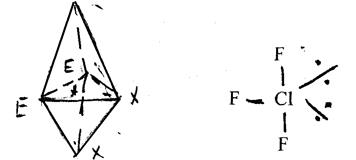 (9)
(9)
г) молекули типу АХ2 Е3 мають лінійну форму, тому що всі три неподілені електронні пари розміщені в екваторіальній площині. Наприклад, ICl2 :
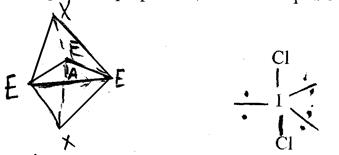 (10)
(10)
6-електронні пари:
а) молекули типу АХ6 мають октаедричну форму. Наприклад, SF6 :
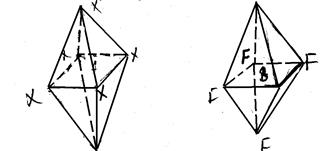 (11)
(11)
б) молекули типу АХ5 Е мають конфігурацію квадратної піраміди (шосту вершину октаедра займає неподілена електронна пара). Наприклад, IF5 :
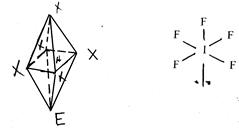 (12)
(12)
в) молекули типу АХ4 Е2 можуть мати дві конфігурації, оскільки неподілені електронні пари можуть знаходитися одна відносно другої в цис- (тобто екваторіальному) або транс- (у вершинах октаедра) положенні:
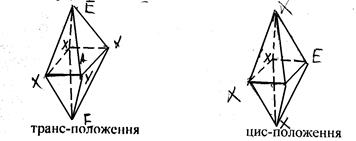
З цих конфігурацій стійкою є та, коли електронні пари розміщені в транс-положенні, що приводить до утворення молекули плоскої форми: плоского квадрата
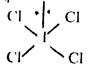 (13)
(13)
г) молекули типу АХ3 Е3 невідомі, але їх структуру можна передбачити
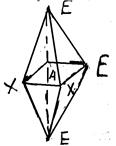
Таку геометричну форму мають молекули з одинарними зв’язками, що мають на зовнішній валентній оболонці від 2 до 6 електронних пар. Тут геометрія молекули повністю визначалася переважаючою конфігурацією електронних пар на валентній оболонці центрального атома. При цьому побічні взаємодії не приймалися до уваги.
В таблиці приведена геометрична форма молекул типу АХm En з одинарними хімічними зв’язками в залежності від числа зв’язуючих і неподілених електронних пар.
Таблиця Геометрична форма молекул в залежності від числа зв’язуючих та неподілених електронних пар
|
К-во Просмотров: 545
Бесплатно скачать Реферат: Геометрія молекул
|