Реферат: Геометрія молекул
d4
тетрагональна піраміда
5
dsp3 , d3 sp
тригональна біпіраміда
ds2 p2 , d4 s, d2 p3 , d4 p
тетрагональна піраміда
d5
пентагональна піраміда
d3 p2
п’ятикутна
6
d2 sp3
октаедр
d4 sp, d5 p
тригональна призма
8
d4 s1 p3
куб
Конфігурацію молекули в залежності від числа зв’язуючих і неподілених пар можна охарактеризувати так. Позначимо: А – центральний; Х – ліганд; Е – неподілена пара електронів. Тоді в молекулі АХm En , яка не містить кратних зв’язків, буде m + n електронних пар на валентній оболонці, з яких m – зв’язуючі пари, а n – неподілені. При цьому форма молекули буде визначатися найбільш імовірним розміщенням m + n електронних пар.
Дві електронні пари мають лінійну конфігурацію, якщо обидві пари електронів зв’язуючі. Наприклад,
Сl – Ве – Сl. (1)
3-хелектронні пари:
а) якщо вони зв’язуючі (молекула АХ3 ), то утворюють плоску форму у вигляді правильного трикутника. Наприклад, BF3
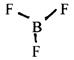 (2)
(2)
б) молекули типу АХ2 Е (з пари електронів, з яких 2 зв’язуючі, 1 неподілена) мають кутову форму. Наприклад, SnCl2 в газовій фазі
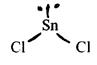
4-електронні пари:
а) молекули типу АХ4 (всі пари зв’язуючі) утворюють тетраедр, наприклад, СН4 :