Реферат: Геометрія молекул
6
1
Одна неподілена електрон-на пара займає вершину октаедра (тетрагональна піраміда)
IF5
АХ4 Е2
6
2
Правильний квадрат
[ICl4 ]–
АХ7
7
–
Пентагональна біпіраміда, кут рівний 72°
IF7
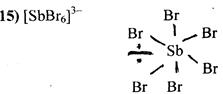
АХ6 Е
7
1
Неподілена електронна пара розхміщується у екваторіальній площині неправильного октаедра
[SbBr6 ]3
Геометрична форма молекул з кратними зв’язками.
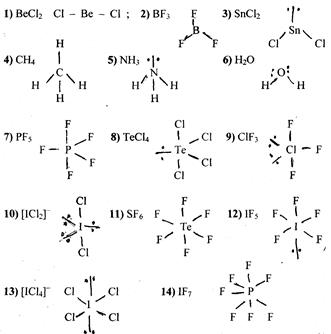
Конфігурація молекул, які містять кратні зв’язки, можна описати аналогічним методом. Існує загальне правило, згідно якого дві орбіталі розміщуються лінійно, три – в формі правильного трикутника, чотири – тетраедрично.
Тому можна очікувати, що дві орбіталі подвійних зв’язків навколо атома С у молекулі СО2 утворять лінійну систему, і молекула СО2 буде лінійною.
Комбінація одинарного і потрійного зв’язків також приводять до лінійної конфігурації молекули: Н–С º N; H–C º C–H.
Два одинарних і один подвійний зв’язок (3 орбіталі) дають трикутну конфігурацію: два одинарні і один подвійний зв’язок атома С у молекулі С2 Н4 розміщені в площині з валентними кутами 120°.
Відомо, що подвійний зв’язок містить один σ- і один π-зв’язок, а потрійний – один σ- і два π-зв’язки. Степінь перекриття орбіталей у π-зв’язку, як правило, менше ніж у σ-зв’язку, і тому π-зв’язки слабші і більш реакційно здатні. S-орбіталі внаслідок своєї кульової симетрії нездатні до утворення π-зв’язків. Тому стереохімія атома в простій молекулі визначається тільки σ-зв’язуючими парами і неподіленими парами електронів, тоді як π-зв’язки не виявляють впливу ( в першому наближенні) на кути між зв’язками (однак π-зв’язки впливають на довжину і енергію зв’язку. В таблиці приведені геометричні конфігурації деяких молекул і іонів з кратними зв’язками.
В молекулі SOF4 оксигену займає екваторіальне положення; в іоні [IO2 F2 ] два атоми фтору займають полярні положення, а атоми оксигену – два із трьох екваторіальних положення тригональної біпіраміди.
Нелокалізований π-зв’язок. Метод ВЗ виходить з положення, що хімічний зв’язок між атомами в молекулі локалізований, тобто ![]() пара належить двом атомам. Проте іноді, виходячи з властивостей багатоатомних молекул, допускають що при утворенні хімічного зв’язку електронні пари можуть розміщувались між кількома атомами. Такі зв’язки називаються нелокалізованими. Прикладами таких іонів є СО3 і NO3 – .
пара належить двом атомам. Проте іноді, виходячи з властивостей багатоатомних молекул, допускають що при утворенні хімічного зв’язку електронні пари можуть розміщувались між кількома атомами. Такі зв’язки називаються нелокалізованими. Прикладами таких іонів є СО3 і NO3 – .