Реферат: Геометрія молекул
Повне число Електронних пар
Число неподілених пар
0
1
2
2
Лінійна, наприклад
HCN
3
Плоский трикутник, [NO3 ]–
Кутова (120°) NOCl
4
Тетраедр [SO4 ]2–
Піраміда, IO3 ]–
Кутова (109,5°) [ClO2 ]–
5
Тригональна біпіра- міда, [SOF4 ]
Неправильний тетраедр, [IO2 F2 ]–
6
Октаедр, [IO6 ]–5
Будова іону СО3 2– можна згідно методу ВЗ представити одною із схем:
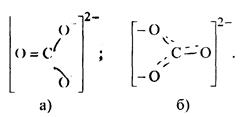
У цих схемах зв’язок С–О нерівноцінний, оскільки атом С з одним атомом оксигену зв’язаний подвійним зв’язком, а з двома іншими одинарним (а). Експериментально встановлено, що всі зв’язки у СО3 2– рівноцінні і іон має форму плоского трикутника з кутом 120°. Такий кут вздовж sp2 – гібридизація атома С. Це означає, що атом вуглецю за рахунок sp2 гібридних орбіталей утворює три σ-зв’язки, а четвертий ![]() утворює π-зв’язок. Щоб зв’язки були рівноцінними, теба допустити делокалізацію π-зв’язку (π-електрон орбіталі) між усіма атомами кисню (б). Розмірковуючи аналогічним чином, можна показати, що [NO3 ]– внаслідок делокалізації зарядів і π-зв’язку всі три атоми оксигену рівноцінні:
утворює π-зв’язок. Щоб зв’язки були рівноцінними, теба допустити делокалізацію π-зв’язку (π-електрон орбіталі) між усіма атомами кисню (б). Розмірковуючи аналогічним чином, можна показати, що [NO3 ]– внаслідок делокалізації зарядів і π-зв’язку всі три атоми оксигену рівноцінні:
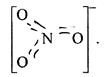
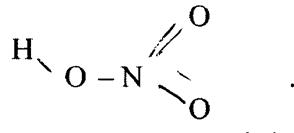
У молекулі HNO3 один із зв’язків N–O одинарний, а два інші близькі до подвійних: