Реферат: Исследование свойств хрома и его соединений
Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента.
1. Исторические сведения
В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец. Спустя несколько лет, в 1770 году, Березовские рудники описал академик П.С.Паллас. «Березовские копи, - писал он, - состоят из четырех рудников, которые разрабатываются с 1752 года. В них наряду с золотом добываются серебро и свинцовые руды, а также находят замечательный красный свинцовый минерал, который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и полупрозрачная... Иногда маленькие неправильные пирамидки этого минерала бывают вкраплены в ква рц подобно маленьким рубинам. При размельчении в порошок она дает красивую желтую краску...». Минерал был назван «сибирским красным свинцом». Впоследствии за ним закрепилось название «крокоит».
Образец этого минерала был в конце XVIII века привезен Палласом в Париж. Крокоитом заинтересовался известный французский химик Луи Никола Воклен. В 1796 году он подверг минерал химическому анализу. «Все образцы этого вещества, которые имеются в нескольких минералогических кабинетах Европы, - писал Воклен в своем отчете, - были получены из этого (Березовского) золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят, что несколько лет назад запасы минерала в руднике истощились и теперь этот минерал покупают на вес золота, в особенности, если он желтый. Образцы минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся для использования их в живописи, где они ценятся за свою желто-оранжевую окраску, не изменяющуюся на воздухе... Красивый красный цвет, прозрачность и кристаллическая форма сибирского красного минерала заставила минералогов заинтересоваться его природой и местом, где он был найден; большой удельный вес и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о наличии свинца в этом минерале...»
В 1797 году Воклен повторил анализ. Растертый в порошок крокоит он поместил в раствор углекислого калия и прокипятил. В результате опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли образовывался красный осадок, после реакции со свинцовой солью появлялся желтый осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся красные кристаллы (это был оксид шестивалентного хрома) смешал с углем, поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был закончен, ученый обнаружил в тигле множество серых сросшихся металлических иголок, весивших в 3 раза меньше, чем исходное вещество. Так впервые был выделен новый элемент. Один из друзей Воклена предложил ему назвать элемент хромом (по-гречески «хрома» - окраска) из-за яркого разнообразного цвета его соединений. Сначала Воклену не понравилось предложенное название, поскольку открытый им металл имел скромную серую окраску и как будто не оправдывал своего имени. Но друзья все же сумели уговорить Воклена и, после того как французская Академия наук по всей форме зарегистрировала его открытие, химики всего мира внесли слово «хром» в списки известных науке элементов.
В 1854 году удалось получить чистый металлический хром электролизом водных растворов хлорида хрома. В металлургии, где расход хрома для легирования сталей очень велик, используют не сам хром, а его сплав с железом - феррохром. Впервые феррохром был получен в 1820 году восстановлением смеси оксидов железа и хрома древесным углем в тигле. В 1865 году был выдан первый патент на хромистую сталь.
2. Хром в природе
Среднее содержание хрома в земной коре 83 г/т, по массе содержание хрома в земной коре составляет 0,035%, в воде морей и океанов 2´10-5 мг/л. Мировые подтвержденные запасы хромовых руд составляют 1,8 млрд. т. Более 60% сосредоточено в ЮАР. Крупными запасами обладают Зимбабве, Казахстан Турция, Индия, Бразилия. Руды хрома имеются в Новой Каледонии, на Кубе, в Греции, Югославии. В то же время такие промышленные страны, как Англия, Франция, ФРГ, Италия, Швеция, совершенно лишены хромового сырья, а США и Канада располагают лишь очень бедными рудами [1]. Запасы хромовых руд России сосредоточены главным образом в группе Сарановских месторождений (Верблюжьегорское, Алапаевское, Халиловское и др.) на Урале (Пермская область) и составляют 6,4 млн. т. (0,36% от мировых запасов).
Добыча хромовых руд в мире составляет около 12 млн. т. в год, в том числе 108 тыс. т. в России. Главные производители товарной хромовой руды - ЮАР, Казахстан, на долю которых приходится более 60% добычи сырья ежегодно.
В Красноярском крае месторождения хрома отсутствуют. Но на правом берегу р.Енисей, в устье р.Березовой (к югу от устья р. Подкаменная Тунгуска) есть рудопроявление с выходом пород 1,5´4 м, возраст пород оценивается в 500 млн. лет. Содержание чистого хрома в руде порядка 42% .
По содержанию Cr2 O3 хромовые руды подразделяются на очень богатые (более 65%), богатые (65-52%), средние (52-45%), бедные (45-30%), убогие (30-10%). Руды, содержащие более 45% Cr2 O3 не требуют обогащения.
| Показатель | Донской ГОК (Казахстан) | Сарановская шахта (Россия, Пермская обл.) | Рудопроявление в Красноярском крае |
| Содержание Cr2 O3 в исходной руде, % | 46,6 | 39,1 | 62 |
3. Свойства хрома. Теоретическая часть
3.1 Об щие сведения
 |
???? Cr - химический элемент VI ?????? ????????????? ??????? ??????????, ??????? ????? 24, ??????? ????? 51,996, ?????? ????? 0,0125, ??????? ????? Cr2+ - 0,0084; Cr3+ - 0,0064; Cr4+ - 6,0056. ????? ?????? ?????????? ??????? ? ???????? ??????? 50, 52, 53, 54, ?????????????????? ??????? ? ??????? ?????????? 4,35%, 83,79%, 9,50%, 2,36%. ?????? ???? ????????? ??????? ????????? +2, +3, +6 (??????????? II, III, VI ??????????????) [4].
Рисунок 1- Структура атома хрома
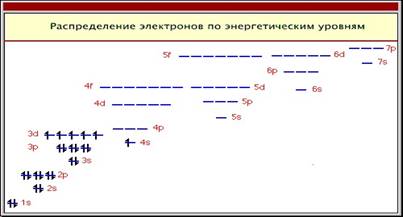
Рисунок 2-Распределение электронов по энергетическим уровням
3.2 Физические свойства
Хром - твердый, довольно тяжелый, пластичный, ковкий металл серо-стального цвета, плавится при 1 878±220 С, кипит при 24690 С [2]. Ничтожные примеси кислорода, азота, углерода резко изменяют физические свойства хрома, в частности он становится хрупким. Получить хром без этих примесей очень трудно. Устойчив к коррозии на воздухе и в воде.
Структура кристаллической решетки объемноцентрированная кубическая.
Хром обладает всеми характерными свойствами металлов - хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имее т присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре около 37°С многие его физические свойства резко, скачкообразно меняются. В этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. Так же внезапно изменяются электропроводность, коэффициент линейного расширения, термоэлектродвижущая сила. Пока ученые не могут достоверно объяснить эту аномалию.
Таблица 1- Физические свойства хрома
| Параметр | Значение |
| Плотность при 200 C | 7,19 г/см3 |
| Температура плавления | 1878±220 С |
| Температура кипения | 2469-2480 0 C |
| Теплота парообразования | 344,4 кДж/Моль |
| Теплопроводность | 93,7 Вт/(м´К) |
| Температурный коэффициент линейного расширения | 6,2´10-6 |
| Удельное электрическое сопротивление | 12,7´10-8 Ом´м |
| Твердость по Бринеллю | 687 МПа |
| Удельная магнитная восприимчивость | +4,45´10-8 м/кг3 |
3.3 Химические свойства
При небольших температурах хром химически мало активен (взаимодействует только с фтором). Выше 6000 C взаимодействует с галогенами, серой, азотом, кремнием, бором, углеродом, кислородом. Взаимодействие с кислородом протекает сначала довольно активно, затем, однако, резко замедляется, так как поверхность покрывается тонкой чрезвычайно устойчивой пленкой, препятствующему дальнейшему окислению. Это явление называется пассивированием . При 12000 C пленка начинает разрушаться, окисление снова идет быстро. При 20000 C хром воспламеняется в кислороде с образованием темно-зеленого оксида Cr2 O3 .
Хром пассивируется холодными концентрированными H2 SO4 и HNO3 , однако при сильном нагревании он растворяется в этих кислотах [3]:
2Cr + 6H2 SO4( конц .) = Cr2 (SO4 )3 + 3SO2 + 6H2 O
Cr + 6HNO3(конц.) = Cr(NO3 )3 + 3NO2 + 3H2 O
Хром растворяется в разбавленных сильных кислотах (HCl и H2 SO4 ). В этих случаях в отсутствии воздуха образуются соли Cr2+ , а на воздухе - соли Cr3+ :
Cr + 2HCl = CrCl2 + H2
4Cr + 12HCl +3O2 = 4CrCl3 + 6H2 O
Нерастворим в H3 PO4 , HClO4 благодаря образованию защитной пленки.
Таблица 2- Основные химические реакции чистого хрома
| Хром реагирует | ||
| 0…600 0 С | 600…1200 0 С | 1200…2000 0 С |
1. со фтором 2Cr0 + 3F2 0 = 2Cr+3 F3 - |
1. с галогенами:
2Cr0 + 3Cl2 0 | 1. с кислородом: 4Cr + 3O2 |
|
2. ссерой:
2Cr0 + 3S0 | ||
|
К-во Просмотров: 752
Бесплатно скачать Реферат: Исследование свойств хрома и его соединений
| ||