Реферат: Химическая термодинамика
![]() (9)
(9)
или d(ΔН )=C p dТ , где С р —теплоемкость при постоянном давлении. При расчете ΔН следует учитывать не только изменение энергосодержания системы в зависимости от температуры, но и изменение агрегатных и полиморфных состояний, при котором происходит поглощение энергии при постоянной температуре:
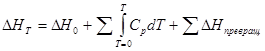 (10)
(10)
Таким образом, энтальпия — сложная математическая функция, определяющая энергию, необходимую для приведения системы в данное состояние, и учитывающая изменение внутренней энергии и совершаемую работу.
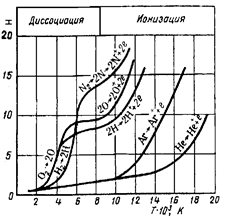 |
На рисунке приведены кривые зависимости энтальпии от температуры для газов, используемых как плазмообразователи в плазмотронах. Для исследования процессов, происходящих в материальных системах, мы пользуемся не абсолютными значениями энтальпий, а их изменением (разностью) между начальным и конечным состояниями системы. Разности энтальпий мы можем измерять с любой степенью точности, отсчитывая энтальпии не от абсолютного |
нуля, а, от любого, но всегда одного и того же уровня. За такой уровень приняты стандартные условия: Т =298,15 К, р =1,013∙105 Па.
Кроме того, для термохимических расчетов приняты следующие два условия:
1. Разность энтальпий простых веществ (ΔН 0 ) в состоянии, устойчивом при стандартных условиях, принимается равной нулю. Например:![]() , но
, но ![]() (так как для образования атомарного водорода при стандартных условиях надо затратить энергию диссоциации, равную 217,9 кДж/моль).
(так как для образования атомарного водорода при стандартных условиях надо затратить энергию диссоциации, равную 217,9 кДж/моль).
2. Разность энтальпий сложного вещества обратна по знаку и равна тепловому эффекту при постоянном давлении (![]() ) реакции его образования из простых веществ в состоянии, устойчивой при стандартных условиях, т.е. энтальпии образования. Например:
) реакции его образования из простых веществ в состоянии, устойчивой при стандартных условиях, т.е. энтальпии образования. Например: ![]() ¾ 241,8 кДж/моль;
¾ 241,8 кДж/моль; ![]() + 90,37 кДж/моль.
+ 90,37 кДж/моль.
В настоящее время стандартные разности энтальпий (ΔН 0 ) и их зависимости от температуры (![]() ) можно найти в справочной литературе для очень большого числа неорганических и органических соединений.
) можно найти в справочной литературе для очень большого числа неорганических и органических соединений.
Термохимические расчеты с использованием табличных данных значительно упростились. Рассмотрим пример расчета разности энтальпий химической реакции в общем виде для уравнения
aA+bB=cC+dD
где А, В, С, D — символы реагирующих веществ: а, Ь, с, d — стехиометрические коэффициенты.
Исходные вещества (аА+ b В ) соответствуют начальному состоянию системы, и сумма их энтальпий вычитается, так как они в результате процесса исчезают, конечные продукты (cC+dD ), составляющие конечную систему, появляются в процессе, и их энтальпии входят со знаком плюс. Если данное вещество в уравнение химической реакции входит с коэффициентом, отличным от единицы, то при суммировании энтальпий эти коэффициенты надо взять как множители.
Во избежание возможных ошибок надо суммирование энтальпий производить непосредственно под уравнением химической реакции
aA+bB=cC+dD
![]()
Подставляя значения энтальпий из справочной литературы, находим ![]() реакции.
реакции.
Чтобы получить разность энтальпий реакций для более высоких температур, чем стандартные, используют зависимость разности энтальпий от температуры и учитывают при этом изменения энергии, потребной для нагрева данных веществ и для изменения ихфазовых состояний:
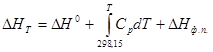 (11)
(11)
Для многих веществ эти функции рассчитаны и приведены в справочных таблицах (ΔНT ¾Н0 ).
Если абсолютное значение разности энтальпий реакций достаточно велико (300—400 кДж), то в первом приближении температурной зависимостью можно пренебречь, так как теплоемкости измеряются в Дж/(моль∙К), а разности энтальпий—в кДж/моль, т.е. на 3 порядка выше.
Для органических соединений в справочных таблицах часто приводится разность энтальпий горения этих веществ, рассчитанная для случая образования жидкой воды, так как обычно определения производятся в калориметрических бомбах, охлаждаемых по окончании опыта до комнатной температуры.
Зная разность энтальпий сгорания, легко определить разностьэнтальпий образования органического вещества. Схема расчета приведена для общего случая горения органического вещества:
![]()
![]()
Отсюда
![]()
Атомы других элементов (Cl, N, S и т.д.), входящие в состав органической молекулы, при горении выделяются в молекулярном виде или в виде устойчивых оксидов (SO2 , P2 O5 ), так как горение происходит в атмосфере кислорода (3∙105 Па).
ЭЛЕМЕНТЫ ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
Первое начало термодинамики — закон сохранения энергии — рассматривает уже свершившиеся процессы, но не указывает направление процесса химической реакции, ее возможность и полноту протекания, а это представляет собой основную задачу при исследовании любого процесса, особенно высокотемпературного.
Так, например, водород и кислород, соединяясь со взрывом, при обычных температурах образуют воду, при высоких температурах реагируют обратимо, а при температуре выше 4000 К существование водяного пара практически невозможно. Таким образом,разность энтальпий реакции еще не определяет возможности ее протекания в данных конкретных физических условиях.