Реферат: Молекулярна спектроскопія
Спектроскопія
Спектри поглинання, випромінювання і розсіювання
Основні характеристики енергетичних рівнів і молекулярних систем
Населеність енергетичних рівнів
Квантування моментів кількості руху і їх проекцій
Форма, положення і інтенсивність смуг в молекулярних спектрах
Види руху у молекулі і типи молекулярних спектрів
Спектроскопія
Спектроскопія – це розділ фізики, що вивчає закономірності взаємодії електромагнітної радіації з речовиною, яка супроводжується процесом поглинання, випромінювання і розсіювання світла.
Із спектроскопічних даних можна одержати інформацію, як про структуру і властивості молекул, так і про сили міжмолекулярної взаємодії, а відповідно про будову речовини в цілому.
В розвитку спектроскопії як методу дослідження речовин можна виділи два основних етапи – до і після 1913 р.
Перший етап – це період емпіричного накопичення фактів – розкладання білого світла у спектр, зв’язок між поглинаючою і випромінюючою властивістю речовини (Кіргоф, 1895 р.), вплив на спектральні лінії зовнішніх магнітних і електричних полів (Зеєман, 1896 р.), а також спроб теоретичного опису і інтерпретації експериментальних залежностей (класична теорія поглинання і дисперсії) – друга половина ХІХ ст.
Другий етап, що розпочався після формулювання Бором в 1913 р. квантових постулатів і бурхливого розвитку квантової теорії, що послідувала після. В цей період спектроскопія поставлена на міцну наукову базу.
Стаціонарні стани, рівні енергії і переходи між ними. Сучасна спектроскопія повністю базується на квантовій теорії, в основі якої лежать фундаментальні квантові закони, що визначають властивості атомів і молекул. У відповідності з першим постулатом Бора , будь-яка атомна або молекулярна система є стійкою лише в певних стаціонарних станах, яким відповідає деяка дискретна (перервна або неперервна) послідовність енергії Е системи. Будь-яка зміна цієї енергії зв’язана із скачкоподібним переходом системи з одного стаціонарного стану в інший. Для конкретних систем послідовність значень енергії Е може бути або цілком дискретною, або цілком неперервною, або частково дискретною і частково неперервною.
По аналогії з поняттям потенціальної енергії тіла піднятого на різну висоту (рівень) в квантовій механіці і спектроскопії прийнято використовувати термін – рівень енергії , або ”енергетичний ” рівень . Це поняття можна проілюструвати графічно так (мал. ).
Е ______________ Еn
______________ En–1
_ _ _ _ _ _ _ _ _ _ Мал. . Схема енергетичних
_ _ _ _ _ _ _ _ _ _ рівнів системи.
______________ E3
______________ E2
______________ E1
Найнижчий рівень енергії називається основним або нормальним , всі інші – збудженими рівнями .
Переходи атомної або молекулярної системи з одного стану в інший пов’язаний, або з одержанням, або з віддачею енергії. Такі переходи можуть бути двох типів.
1. Радіаційні переходи – при яких атом або молекула поглинають, випромінюють або розсіюють електромагнітну радіацію.
2. Нерадіаційні переходи – при яких проходить обмін енергії даної системи з якими-небудь іншими системами.
Ці процеси зручно представляти графічно з допомогою стрілок: радіаційні переходи – прямими стрілками, нерадіаційні – вигнутими або хвильовими.
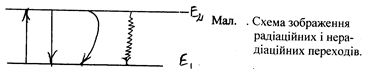
Мал. . Схема зображення радіаційних і нера-діаційних переходів.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--