Реферат: Молекулярна спектроскопія
В законі квантування проекції моменту кількості руху закладений фізичний зміст виродження енергетичних рівнів. Рівень енергії із заданим значенням j завжди вироджений, причому степінь виродження: gj = 2j + 1.
Форма, положення і інтенсивність смуг в молекулярних спектрах
Кожен реальний рівень енергії характеризується деякою шириною δЕ, а кожен квантовий перехід і відповідна йому спектральна смуга не є монохроматичними і займають у спектрі деякий інтервал частот δv , при цьому
δEij ≈ δE1 + δEj ; δnij = ![]() .
.
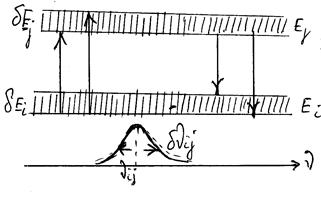
Мал. . Схема переходів між енергетичними рівнями, що мають деяку кінцеву ширину.
Виходячи з співвідношення невизначеності між часом і енергією, можемо записати:
δЕ · δt = ![]() ,
,
де δt – час перебування системи в якому-небудь стані,
δЕ – характеризує інтервал можливих енергій однієї системи.
Рівень буде нескінченно вузьким лише при δt ® ¥; такою є природна ширина основного або нормального стану молекули.
Види руху у молекулі і типи молекулярних спектрів
Особливостями молекулярних спектрів є те, що вони відрізняють їх від атомних спектрів, і визначаються тим, що рух часток, що утворюють молекулу, значно складніший, ніж у атомах. Поряд з рухом електронів (як валентних, тобто тих, що приймають участь в утворенні хімічного зв’язку, так і локалізованих біля ядер відповідних атомів), в молекулі може відчуватись періодична зміна відносного положення ядер (коливний рух молекули), а також періодична зміна її орієнтації в просторі як цілого (обертовий рух молекули).
У відповідності з сучасними уявленнями, повна енергія молекули Е в будь-якому стаціонарному стані може бути приблизно представлена як сума електронного, коливного і обертового руху, тобто
Е = Еел + Екол + Еоб .
Але слід підкреслити, що при більш строгому розгляді необхідно враховувати також взаємодію різних видів руху молекули один з одним, тобто
Е = Еел + Екол + Еоб + Е¢ел–кол + Е¢ел–об + Е¢кол–об ,
Е¢ – відповідні енергії взаємодії.
Теорія і експеримент показують, що електронна енергія молекули значно перевищує коливну, а коливна – обертову, тобто
Еел >> Eкол >> Eоб .
Порівняння коливної і електронної енергій. З класичної точки зору електронні спектри відповідають коливанням пружно зв’язаного електрона, частота якого рівна
![]() ,
,
де Kел – силова постійна (постійна пружного зв’язку електрона),
mел – маса електрона.
Коливні спектри відповідають коливному руху ядер відносно одне одного, і частота коливання виражається формулою
![]() ,
,
де М – приведена маса ядер: ![]() (М1 і М2 – маси зв’язаних ядер),
(М1 і М2 – маси зв’язаних ядер),
K – силові постійні, що характеризують коливний рух ядер.
Для молекул Kел = Kкол . Еел = hnел , Екол = hnкол .
![]() .
.
Порівняння обертової енергії з електронною. Електронна енергія рівна кінетичній енергії обертання електронів навколо ядра: