Учебное пособие: Квантово-механічна теорія будови речовини
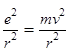
де m – маса ē; е – заряд ē; v – швидкість руху ē; r – радіус орбіталі.
Діаметр атома складає ~10–8 см, а діаметр ядра ~10–13 – 10–12 см.
Результати обчислень показали, що заряд ядра рівний порядковому номеру елемента в періодичній системі.
Відомо, якщо сонячний промінь пропускати крізь кварцову призму, то він розкладається і на екрані, поставленому за призмою, виникає кольорова смуга, яка містить усі кольори райдуги. Це пояснюється тим, що білий промінь складається з електромагнітних хвиль різної довжини, які при проходженні через призму заломлюються нею неодинаково і потрапляють на різні ділянки екрану. Такий спектр називається суцільним.
Світло, яке випромінюється розжареним газом або парою складається з електромагнітних хвиль певної довжини. Тому замість суцільної смуги на екрані виникає ряд окремих кольорових ліній, розділених темними проміжками. Так, наприклад, у видимій частині спектра водню міститься п’ять ліній: червона, зелена, синя і дві фіолетові. Спектр калію складається з трьох ліній – дві червоні і одна фіолетова. Такі спектри називаються лінійчатими. Кожному хімічному елементу відповідає свій атомний спектр, який відрізняється від спектрів інших елементів. Модель атома Резерфорда не могла пояснити лінійчатий характер атомних спектрів. Більше того, вона їм суперечила.
Квантова теорія світла
У 1900 р. німецький вчений М. Планк вивчаючи природу випромінювання нагрітих твердих тіл висловив припущення, що енергія випромінюється і поглинається не безперервно, а дискретно, певними порціями – квантами, пропорційними частоті коливань. Тобто перехід від одного енергетичного стану до найближчого іншого супроводжується випромінюванням або поглинанням енергії у вигляді певних порцій – квантів енергії:
Е = hn – рівняння Планка
де n – частота; h – стала Планка = 6,625 · 10–34 Дж·с.
Постулат Планка був обгрунтований у 1905 р. А. Ейнштейном, який аналізуючи явище фотоефекту дійшов висновку, що електромагнітна (промениста) енергія існує лише у формі квантів і випромінювання є потоком неподільних матеріальних часток (фотонів), енергія яких визначається рівнянням Планка.
З погляду класичної механіки обертання ē з масою m навколо ядра атома визначається моментом кількості руху – mvr. Припускається, що v і r можуть змінюватися як завгодно і неперервно.
У квантовій механіці енергія ē, що рухається, може змінюватися тільки квантами. Це означає, що величини r і v також мають змінюватися стрибкоподібно. В квантовій механіці момент кількості руху виражається співвідношенням
![]() і може дорівнювати n
і може дорівнювати n![]()
де n = 1,2,3,4.... будь-яке ціле число
Теорія Бора. Пояснення лінійчатого характеру атомних спектрів
Враховуючи квантову теорію світла, лінійчатий характер атомних спектрів, планетарну модель будови атома Резерфорда Н. Бор у 1913 р. сформулював основні свої теорії для атома водню у вигляді постулатів.
1. Поняття стаціонарної орбіталі, перебуваючи на яких електрон не поглинає і не випромінює енергію. Для електронів, що рухаються на таких орбіталях, момент кількості руху повинен бути цілим кратним кількості ![]() :
:
me vr = n![]() (1)
(1)
me – маса електрона; v – швидкість руху електрона;
r – радіус орбіти (віддаль між центром ядра і електроном);
n – будь-яке ціле число; h – стала Планка.
З формули (1) визначаємо v:
![]() (2)
(2)
Вважаючи, що електрон утримується на такій орбіті внаслідок урівноваження двох сил, що діють на нього: сила електростатичного притягання його ядром і центробіжна сила його оберту. Можемо записати:
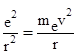 (3)
(3)
е – заряд електрона і ядра.
З рівняння (3) визначаємо r:
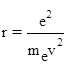 (4)
(4)
Підставляємо в (4) значення v із (2):
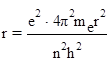 (5)
(5)