Учебное пособие: Квантово-механічна теорія будови речовини
Потім висунув гіпотезу, що рух таких часток, як електрони, пов’язаний з хвильовим рухом, довжина хвилі якого має вираз аналогічний відповідному рівнянню для фотонів λ = ![]() , де m – маса частки (в г); v – швидкість руху частки (см/сек). Ця гіпотеза про хвильову природу електронів одержала експериментальне підтвердження, коли Девіссон і Джермер (1927 р.) і Томсон і Рід (1928 р.) незалежно один від одного показали, що пучок електронів може давати дифракційний інтерференційний ефект. Це явище можна пояснити тільки, якщо електронному пучку приписати хвильові властивості. Тому можна сказати, що не тільки світлові хвилі ведуть себе як потік малих часток (фотонів), але і потоки малих часток , таких як електрони. Це протиріччя було розв’язане за допомогою принципа невизначенності Гейзенберга (1927 р.). Цей принцип можна проілюструвати ”уявним експериментом”, в якому розглядається поведінка даної системи при даних умовах. Припустимо, що електронна пушка може вистрілити один електрон, направивши його горизонтально з відомою швидкістю в абсолютно вакуумовану посудину.
, де m – маса частки (в г); v – швидкість руху частки (см/сек). Ця гіпотеза про хвильову природу електронів одержала експериментальне підтвердження, коли Девіссон і Джермер (1927 р.) і Томсон і Рід (1928 р.) незалежно один від одного показали, що пучок електронів може давати дифракційний інтерференційний ефект. Це явище можна пояснити тільки, якщо електронному пучку приписати хвильові властивості. Тому можна сказати, що не тільки світлові хвилі ведуть себе як потік малих часток (фотонів), але і потоки малих часток , таких як електрони. Це протиріччя було розв’язане за допомогою принципа невизначенності Гейзенберга (1927 р.). Цей принцип можна проілюструвати ”уявним експериментом”, в якому розглядається поведінка даної системи при даних умовах. Припустимо, що електронна пушка може вистрілити один електрон, направивши його горизонтально з відомою швидкістю в абсолютно вакуумовану посудину.
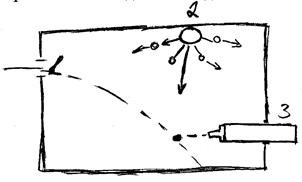
Мал. . Уявний експеримент Гейзенберга:
1 – електронна пушка; 2 – джерело світла;
3 – мікроскоп.
Джерело світла (2) може випускати фотони будь-якої необхідної енергії (тобто частоти або довжини хвилі). Єдиний електрон можна спостерігати в ідеальний мікроскоп. Спочатку електрон буде рухатись по параболічній траєкторії під дією гравітаційного поля Землі. Але, коли він зіткнеться з фотоном, що має певну масу, то він відскочить і його швидкість зміниться. Тому, ведучи спостереження через послідовно малі проміжки часу можна помітити, що електрон рухається зигзагоподібно під впливом послідовних зіткнень з фотоном.
Якщо енергію фотонів (hn) знизити, то можна зменшити вплив зіткнень. Однак, це приведе до збільшення довжини хвилі ![]() світла і тому електрон буде визначатися менш точно, внаслідок зниження роздільної здатності мікроскопа. Таким чином, при використанні світла низької частоти можна точно знати швидкість електрона, але не його положення.
світла і тому електрон буде визначатися менш точно, внаслідок зниження роздільної здатності мікроскопа. Таким чином, при використанні світла низької частоти можна точно знати швидкість електрона, але не його положення.
З іншого боку, світло з короткою довжиною хвилі складається з фотонів високої енергії (hn) і хоча диференційні помилки в мікроскопі будуть невеликими, але на швидкість мікрона буде сильно впливати кожне зіткнення з фотоном. Таким чином при використанні такого випромінювання можна знати положення електрона, але не його швидкість. Гейзенберг показав, що добуток невизначеностей положення і швидкості не може бути меншим від ![]() , тобто Dt · Dv ³
, тобто Dt · Dv ³ ![]() . Отже, Гейзенберг вважав, що в атомних масштабах траєкторію частки уже не можна розглядати з математичною точністю, а замість цього повинна існувати смуга невизначеності, в якій частка може рухатися по всій області можливих положень. Цей рух має характерні риси хвильового руху і тому його можна трактувати на основі рівнянь хвильової теорії; цей предмет відомий як хвильова механіка.
. Отже, Гейзенберг вважав, що в атомних масштабах траєкторію частки уже не можна розглядати з математичною точністю, а замість цього повинна існувати смуга невизначеності, в якій частка може рухатися по всій області можливих положень. Цей рух має характерні риси хвильового руху і тому його можна трактувати на основі рівнянь хвильової теорії; цей предмет відомий як хвильова механіка.
З попереднього випливає, що можна розглядати тільки імовірність того, що частка буде в даному місці в даний момент і можна сформулювати принцип невизначеності: в принципі неможливо точно визначити і положення, і швидкість частки атомного масштабу.
В ролі моделі стану електрона в атомі в квантовій механіці прийнято уявлення про електронну хмару, густина відповідних ділянок якої пропорційна імовірності знаходження там електрона. Простір навколо ядра, в якому перебування електрона найбільш імовірне, називається орбіталю.
Розподіл електронної густини навколо ядра можна за допомогою кривих радіального розподілу (мал. ).
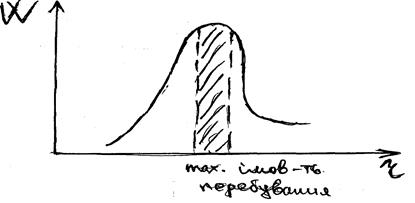
Мал. Радіальний розподіл імовірності знаходження електрона в атомі для 1s орбіталі атома водню
Ця крива показує імовірність того, що електрон знаходиться в тонкому концентричному кулеподібному шарі радіусом r, товщиною dr навколо ядра. Об’єм цього шару рівний dV = 4pr2 dr.
У 1926 р. Е. Шредінгер запропонував рівняння, що одержало назву хвильового рівняння Шредінгера. Воно зв’язує хвильову функцію y з потенціальною енергією електрона (u) і його повною енергією Е:
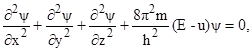
де m – маса електрона; h – стала Планка; Е – загальна енергія електрона; u – потенціальна енергія електрона. Треба зазначити, що допустимі розв’язки рівняння Шредінгера можливі тільки для певних дискретних значень енергії електрона.
Кожній функції y1 , y2 , y3 , ..., yn , яка є розв’язком хвильового рівняння відповідає певне значення енергії Е1 , Е2 , Е3 , ..., Еn . Стан електрона в атомі характеризується значенням чотирьох квантових чисел: n – головного; l – орбітального; me – магнітного; s – спінового.
Квантування енергії, хвильовий характер руху мікрочасток, принцип невизначеності показують, що класична механіка непридатна для опису поведінки мікрочасток. Так, стан електрона в атомі не можна уявити як рух матеріальної частки по якій-небудь траєкторії. Квантова механіка замінює класичне поняття точного знаходження електрона в даній точці поняттям статистичної імовірності знаходження електрона в елементі об’єму dV навколо ядра.
Оскільки рух електрона має хвильовий характер, квантова механіка описує його рух в атомі так званою хвильовою функцією y. В різних точках атомного простору ця функція приймає різні значення. Математично це записується рівнянням y = y(х, у, z), де х, у і z координати точки. Певний фізичний зміст має y2 , який характеризує імовірність знаходження електрона в даній точці атомного простору. Величина y2 dV представляє собою імовірність виявлення мікрочастки в елементі об’єма dV.
Головне квантове число (n) визначає радіус квантового рівня (середню віддаль від ядра до ділянки з максимальною електронною густиною) і загальну енергію електрона на певному рівні. Воно може мати додатні цілі числа: n = 1,2,3,..,¥. Якщо n = 1, то електрон має найменшу енергію, а стан атома з найменшою енергією називається нормальним або основним. Із збільшенням значення n загальна енергія електрона збільшується, а стан атома при цьому називається збудженим. Тому стан електрона, який характеризується певним значенням головного квантового числа, називається енергетичним рівнем електрона в атомі. Для енергетичих рівнів електрона в атомі, що відповідають значенням n, прийняте позначення великими латинськими буквами:
n 1 2 3 4 5 6 7
енергетичні рівні K L M N O P Q.
Максимальна кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періода, в якому розміщений певний хімічний елемент. Головне квантове число визначає і розміри електронної хмари: зменшення зв’язку енергії електрона з ядром відповідає збільшенню об’єму хмари і навпаки.
Основні енергетичні рівні складаються з певного числа енергетичних підрівнів, які проявляються в тонкій структурі атомних спектрів. Для характеристики енергії електрона на підрівні, або форми електронних орбіталей, введено орбітальне квантове число l, яке називається також азімутальним квантовим числом. Воно відповідає значенню орбітального моменту кількості руху електрона і обчислюється за формулою:
М = ![]()
Орбітальне квантове число (l) може мати значення від 0 до n – 1. Кожному значенню l відповідає певний підрівень. Енергетичні підрівні позначаються цифрами і маленькими латинськими буквами:
l 0 1 2 3
енергетичні рівні s p d f.