Учебное пособие: Квантово-механічна теорія будови речовини
Для першої стаціонарної орбіталі n = 1:
r1 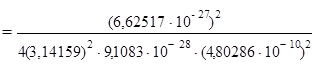 = 0,529172 · 10–8 см;
= 0,529172 · 10–8 см;
r2 = 22 · r1 = 4 r1 ; r3 = 9 r1 ; r4 = 16 r1 , тобто r1 : r2 : r3 ... = 12 : 22 : 32 : 42 ...
З двох рівнянь (7) і (8) можна визначити швидкість руху електрона
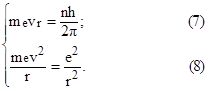
Для цього визначимо r з рівнянь (7) і (8), і прирівняємо між собою:
![]()
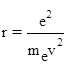 ;
; ![]()
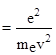 ;
;
![]() (9)
(9)
Підставивши значення p, me , e і h в (9), одержимо:
vn = 2,187 · 10–6 ![]() м/сек.
м/сек.
2. Другий постулат Бора говорить про те, що випромінювання або поглинання енергії проходить квантами при переході електрона з одної стаціонарної орбіталі на іншу.
Вважаючи потенціальну енергію електрона, що знаходиться в нескінченності, рівній нулю, то потенціальна енергія електрона, що перебуває на віддалі r, має слідуюче значення:
Епот = –![]() = –
= –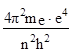 (10)
(10)
(у рівняння (10) підставили значення r із формули (6)).
Значення кінетичної енергії електрона наступне:
Екін = –![]() = –
= –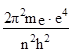 (11)
(11)
(у рівняння (11) підставили значення v із формули (2)).
Тоді повна енергія електрона рівна:
Е = Епот + Екін = –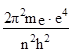
Зміна енергії атома при переході електрона з орбіти n = b на орбіту з n = a буде визначатись рівнянням
Еb – Еa = hn = 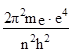
![]() ;
;
n = 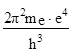
![]() ; n = R
; n = R![]() (R – стала Рідберга)
(R – стала Рідберга)
В результаті Н. Бор визначив сталу Рідберга і показав, що найменше значення енергії електрона атома водню рівне (–R). При переході електрона з одної можливої орбіти на іншу поглинається або випромінюється енергія (мал. ).
Але теорія Бора не спроможна була пояснити порядок розміщення декількох електронів на орбіталі. Складна структура спектру багатоелектронних атомів вимагала більш глибокого наукового пояснення.
Подальше удосконалення теорії будови атома пов’язане з хвильовим характером руху мікрочасток і ймовірним методом опису мікрооб’єктів. У 20-х роках ХХ століття завдяки роботам де Бройль, Е. Шредінгера, В. Гейзенберга були розроблені основи хвильової теорії про корпускулярно-хвильову природу світла.
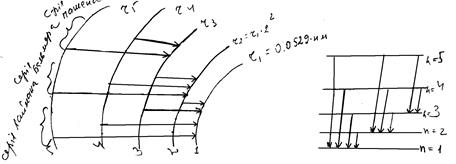
Мал. . Схема виникнення водневого спектру.
У 1924 р. де Бройль, розвиваючи теорію квантів, ввів поняття про «корпускулярні» хвилі. Він відмітив, що для фотонів повинні виконуватись два основних рівняння:
Е = hn; E = mс2 ; mс2 = hn; mс2 = h![]() ; n =
; n = ![]() ; λ =
; λ = ![]() ;
;