Дипломная работа: Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si
Состав γ-фазы по диаграмме состояния Ni-Si
| T, 0 С | T, К | xS i (γ) | xNi (γ) |
| 793 | 1066 | 0,100 | 0,900 |
| 821 | 1094 | 0,105 | 0,895 |
| 870 | 1143 | 0,110 | 0,890 |
| 910 | 1183 | 0,115 | 0,885 |
| 933 | 1206 | 0,120 | 0,880 |
| 953 | 1226 | 0,125 | 0,875 |
| 974 | 1247 | 0,130 | 0,870 |
| 988 | 1261 | 0,135 | 0,865 |
| 1005 | 1278 | 0,140 | 0,860 |
| 1020 | 1293 | 0,145 | 0,855 |
| 1033 | 1306 | 0,150 | 0,850 |
Решая систему уравнений (1.19), получаем значения энергий смешения (табл.1.4). Q12 <0, следовательно, раствор имеет отрицательные отклонения от закона идеальности.
Таблица 1.4
Энергии смешения для γ-фазы
| № | T, К | Q12 , Дж/моль |
| 1 | 1066 | -165626,7 |
| 2 | 1094 | -165257,0 |
| 3 | 1143 | -163418,7 |
| 4 | 1183 | -162127,0 |
| 5 | 1206 | -161927,6 |
| 6 | 1226 | -161878,5 |
| 7 | 1247 | -161708,6 |
| 8 | 1261 | -161963,2 |
| 9 | 1278 | -161961,2 |
| 10 | 1293, | -162043,7 |
| 11 | 1306 | -162211,6 |
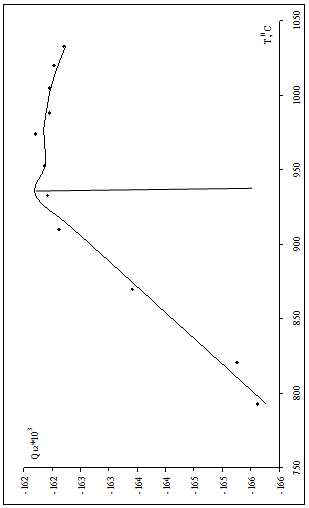
Рис.1.2 Зависимость энергии смешения от температуры.
Строим зависимость энергии смешения от температуры, аппроксимируем полученную функцию по частям (рис.1.2)
в области низких температур при мольной доле кремния 0,1-0,12 функцию зависимости энергии смешения аппроксимировали линейно:
![]() , R2 =0,9802; (1.20)
, R2 =0,9802; (1.20)
при мольной доле от 0,12 до 0,15 полиномиальная аппроксимация:
![]() , R2 =0,8098; (1.21)
, R2 =0,8098; (1.21)
1.5 Термодинамические функции образования интерметаллидов
Согласование энергий Гиббса образования бинарных интерметаллидов систем Ni - Si.
В системе Ni-Siпри низких температурах термодинамически устойчив твердый раствор кремния в никеле с решеткой г. ц. к., существуют интерметаллидные фазы β1 ( Ni3 Si), δ (Ni2 Si), ε (Ni3 Si2 ), αNiSi2 и NiSi. Стандартные энергии Гиббса образования этих интерметаллидов приведены в таблице 1.5 [6].
Таблица 1.5.
Стандартные энергии Гиббса образования интерметаллидов
| Соединение | |
| β1 ( Ni3 Si) | -150,800 |
| δ (Ni2 Si) | -143,100 |
| ε (Ni3 Si2 ) | -232,000 |
| αNiSi2 | -94, 200 |
| NiSi | -89,600 |
1.6. Фазовые диаграммы состояния систем Ni-O и Si-O
Методы расчета фазовых диаграмм состояния металл-кислород.
Химическая устойчивость металлов в окислительной газовой среде, например, на воздухе, определяется их стойкостью к окислению кислородом. Лучшим способом представления термодинамической информации об окислении металлических материалов являются фазовые диаграммы состояния систем металл-кислород.
На фазовых диаграммах Ме-О представлены различные химические равновесия, играющие роль в процессе окисления металла. Они характеризуют растворимость кислорода в данном металле, состав оксидных форм, образующихся в результате окислении металла кислородом, и устойчивость фаз в зависимости от различных параметров системы: температуры, давления, состава и др.
Состав системы выражается содержанием металла и кислорода в атомных процентах, либо в процентах по массе.
Для более сложных систем, содержащих третий компонент - другой металл, существуют аналогичные диаграммы состояния Ме1 -Ме2 -О. Они позволяют разобраться в вопросах состава и структуры окалины (слоев окислов) на поверхности бинарных сплавов. В литературе накоплен огромный справочный материал по термодинамическим свойствам неорганических веществ, сформулированы общие принципы фазовых равновесий в гетерогенных системах (правило фаз Гиббса), предложены различные модели, интерполирующие свойства компонентов и металлических, и оксидных растворов (теории совершенных и "регулярных" растворов) и т.п. Все это позволило расчетным путем выявить вид и характерные особенности интересующих нас диаграмм состояния [7].
Согласно закону равновесия фаз - правилу фаз Гиббса, в трехкомпонентной системе при постоянных внешних параметрах (P,T=const):
f=3-Ф; (1.22)
где f - число термодинамических степеней свободы, или вариантность системы, то есть количество параметров (температура, давление, концентрации компонентов в фазах), которые являются независимыми,
Ф - количество фаз в системе, находящихся в равновесии.
Из физических соображений следует, что f![]() 0. Таким образом, в указанной системе возможны равновесия с участием одной, двух или максимум трех фаз:
0. Таким образом, в указанной системе возможны равновесия с участием одной, двух или максимум трех фаз:
однофазные равновесия (f=2); отдельные фазы (вещества) термодинамически устойчивы в определенном интервале составов и, соответственно, парциальных давлений кислорода;
двухфазные (моновариантные) равновесия (f=1);
трехфазные (нонвариантные) равновесия (f=0).
В условиях трехфазного равновесия система не имеет степеней свободы, т.е. данное состояние системы полностью описывается законами действующих масс гетерогенных химических реакций и условиями нормировки составов фаз. Для однозначного расчета составов фаз в условиях двухфазового равновесия необходимо задаваться одним из параметров системы.