Дипломная работа: Вплив структури аліфатичних карбонових кислот та третинних амінів на каталітичний ацидоліз епіхлоргідрину
1. ЛІТЕРАТУРНИЙ ОГЛЯД
1.1 Загальні уявлення про розкриття епоксидного циклу під дією нуклеофільних реагентів
Реакція α-оксидів з карбоновими кислотами у присутності основних каталізаторів вивчається як у надлишку α-оксиду, так і у надлишку кислоти [6]. З високим виходом при цьому утворюються відповідні оксіефіри. Однак питання про напрямок розкриття α-оксидного кільця є дискусійним.
Відомо, що реакції заміщених оксидів етилену з амінами та нуклеофільними реагентами типу спиртів та фенолів протікають у більшості випадків у відповідності з правилом Красуського [6]. Кислі реагенти, а також нейтральні у присутності кислих каталізаторів взаємодіють з α-оксидами всупереч цьому правилу, однак частіше при цьому утворюється суміш ізомерів – первинних та вторинних спиртів [3].
Літературні дані про напрямок розкриття α-оксидного кільця досить суперечливі. Це може бути пояснено недосконалістю методів розділення та аналізу двох ізомерних продуктів, труднощами отримання можливих ізомерів зустрічним синтезом, можливістю взаємоперетворення ізомерних продуктів за рахунок внутрішньомолекулярної міграції ацильних радикалів [6].
1.2 Напрямок розкриття α-окисного циклу
В епоксидному циклі є два атоми карбону та будь-який з них може підвергатися нуклеофільній атаці. У симетричному епоксидному циклі, наприклад, оксиді етилену, обидва атоми карбону є еквівалентними і атака направляється по одному та другому атомам випадковим чином. Але у несиметричному епоксидні атоми карбону не є еквівалентними та будова продукту реакції, що утворюється, визначається тим, який з цих атомів атакується переважно [4].
Доводиться, що переважне місце атаки залежить головним чином від того, чим каналізується реакція – кислотами чи основами:
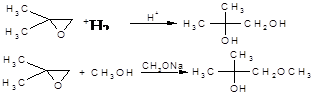
В цих реакціях, як і в загалі завжди, нуклеофіл атакує більш заміщений атом вуглецю при розщепленні, що каналізується кислотами, та менш заміщений атом карбону при розщепленні, що каналізується основами [4].
Це вказує на реалізацію двох механізмів – SN1 та SN2 . Однак є дані, які чітко показують, що обидва механізми відносяться до SN2 – типу: розщеплення зв’язку С─О та атака нуклеофіла протікають в одну стадію.
В реакції SN2 атом карбону віддає електрони групі, що відходить, та отримує електрони від нуклеофіла, в результаті чого він не отримує помітного позитивного чи негативного заряду у перехідному стані; електронні фактори не суттєві для хода реакції, і вона контролюється просторовими факторами. Однак у розщепленні епокисі, що каналізується кислотою, зв’язок С─О, вже послаблений кутовою напругою у трьохчленному кільці, ще більш послаблюється внаслідок протонування. Хоча у перехідному стані спостерігається як розрив, так і утворення зв’язку, розрив зв’язку протікає у більшому ступені, ніж його утворення; група, що відходить, відтягує за собою електрони у значно більшому ступені, ніж нуклеофіл надає їх, і атом карбону набуває значного позитивного заряду [4].
У цьому випадку просторові перешкоди значно менш важливі, оскільки як група, що відходить, так і нуклеофіл знаходяться достатньо далеко. Стійкість перехідного стану визначається в основному електронними, а не просторовими факторами: атакується не найменш заміщений атом карбону, а атом карбону, який найкраще може розмістити позитивний заряд (про таку реакцію говорять, що вона має значний SN1 – характер).
SN2 – розкриття кільця, що каналізується кислотою:
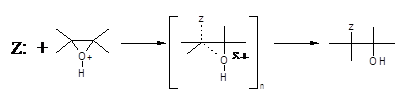
У розщепленні, що каталізується основами, група, яка відходить, значно менш ефективна, а нуклеофіл є дуже ефективним. Розрив та утворення зв’язку відбуваються майже в однаковій мірі, і реакційна здатність контролюється, як завжди, просторовими факторами.
SN2 – розкриття кільця, що каналізується основою:
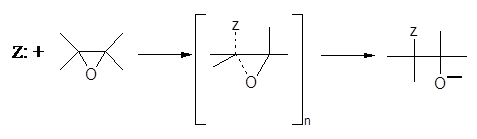
Нуклеофільна атака епоксидного циклу у некислому середовищі була добре вивчена; широкий діапазон реакцій вказує на другий порядок реакції, що відповідає SN2 – механізму [7].
Пакер та Ісакс висказали ідею, що розрив зв’язку є більш важливим фактором, ніж його поява в утворенні перехідного стану [4].
Механізм реакції розкриття епоксидного циклу у кислому середовищі не був вивчений досконально.
Існує майже рівна імовірність на енергетичному рівні двох механізмів. Таким чином, кінетичний критерій щодо механізму є незадовільне ним та можуть бути використані альтернативні критерії [7].
Прітчард та Лонг вивчали кінетику та співвідношення отриманих продуктів реакції гідролізу алкілзаміщених оксидів етилену у кислому середовищі [7]. Виходячи з кореляції між константами швидкості та функції Гамету Н0 , вони зробили висновок, що реакція протікає за механізмом А1 .
Другим критерієм щодо встановлення механізму розкриття епоксидного циклу було використання рівняння Тафта:
![]() (1.1), де
(1.1), де
![]() константи швидкості заміщеного епоксидну та пропілен оксиду відповідно;
константи швидкості заміщеного епоксидну та пропілен оксиду відповідно;
![]() константа замісника;
константа замісника;
![]() константа реакції
константа реакції
Вчені отримали величину ![]() та висловили думку, що це є вказівкою на протікання реакції за механізмом А1 [7].
та висловили думку, що це є вказівкою на протікання реакції за механізмом А1 [7].