Контрольная работа: Обертові, коливні і електронні спектри молекул
Еоб = ![]() .
.
Вираз для енергії обертання сферичного ротатора аналогічний до такого для лінійної молекули. Виходячи з квантової теорії
Еоб j = 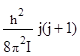 .
.
Тоді схема енергетичних рівнів для сферичного ротатора аналогічна до таких для лінійних молекул.
Різниця між цими рівнями буде у степені їх виродження, яка зв’язана, як відомо, з числом ступенів волі. Обертання лінійної молекули характеризується двома ступенями волі (j, mj ), а обертання молекули типу сферичного ротатора характеризується трьома ступенями волі, а це задається трьома квантовими числами. Третім квантовим числом, крім j, mj є k, яке визначає проекцію обертового моменту кількості руху на одну з рухомих осей. Напрямок цієї осі вибирається довільно, але ця вісь обов’язково обертається разом з молекулою. Проекція обертового моменту кількості руху на цю вісь вибирає квантове число k.
Молекули типу сферичної дзиги внаслідок високої симетрії не мають дипольного моменту і тому не можуть мати чисті спектри обертання, як поглинання, так і випромінювання.
Моменти інерції і обертові постійні молекул типу симетричного ротатору . Симетричні ротатори характеризуються двома рівними моментами інерції. Будемо позначати через а і с осі, які відповідають найменшому і найбільшому моменту інерції молекули, а через b – вісь, якій відповідає проміжковий або середній момент інерції. Тоді одержимо: Іа £ Іb £ Іс . Для симетричного ротатора можливі два випадки – витягнута дзига з виділеною віссю а і сплюснута дзига з виділеною віссю с. Для витягнутої дзиги Іа < Іb = Іс ; для сплюснутої – Іа = Іb < Іс . Таким чином, виділеною віссю (тобто віссю z) є вісь а найменшого моменту інерції для витягнутого ротатора і вісь с найбільшого моменту інерції для сплюснутого ротатора (мал.).
Трьом моментам інерції Іа , Іb , Іс відповідають три обертові постійні, які позначаємо А, В, С:
А = ![]() ; B =
; B = ![]() ; C =
; C = ![]() .
.
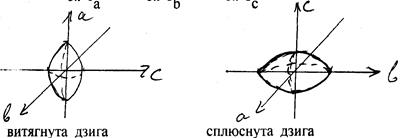
Для обертових постійних симетричного ротатора: витягнутого – А > B = С, сплюснутого – А = В > С.
Обертова енергія симетричного ротатора задається двома квантовими числами j і k. k – проекція повного обертового моменту кількості руху молекули на рухому вісь і набуває значення від – j до +j (2j + 1). Тоді: j = 0, 1, 2, 3…; k = 0, ±1, ±2….
Степінь виродження енергетичних рівнів симетричного ротатора qj , k = 2 (2j + 1), тоді заселеність енергетичних рівнів:
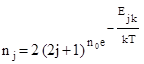 .
.
Правила відбору (дозволені переходи між комбінуючими енергетичними рівнями) Δj = ±1; Δk = 0.
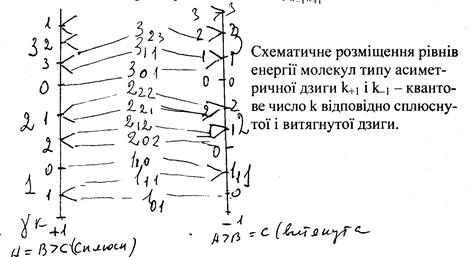
Система енергетичних рівнів симетричного ротатора визначається двома квантовими числами. Схема розміщення цих рівнів для витягнутого і сплющеного ротатора приведена на мал.
Якщо врахувати центробіжні сили між ядрами, то для
Еjk = 2Bj (j + 1) – 4Dj (j +1)3 – 2Djk (j + 1) k2 .
Спектри обертання молекул типу асиметричного ротатора
Для молекул типу асиметричного ротатора всі три моменти інерції різні: Іа < Іb < Іс і відповідно A > B > C. Характер асиметрії може бути виражений через параметр асиметрії Х = ![]() .
.

Для витягнутої дзиги: А > B = C, тобто В = С: Х = ![]() . Для сплющеної дзиги: А = В > C: Х =
. Для сплющеної дзиги: А = В > C: Х = ![]() . Найбільшою асиметрією володіють молекули з Х= 0, при цьому В =
. Найбільшою асиметрією володіють молекули з Х= 0, при цьому В = ![]() , тобто обертове постійне В є середньою між А і С. Енергетичні рівні асиметричної дзиги описуються рівнями:
, тобто обертове постійне В є середньою між А і С. Енергетичні рівні асиметричної дзиги описуються рівнями:
![]() ,
,
![]() – функція параметра асиметрії Х.
– функція параметра асиметрії Х.
Для кожного j існує 2j + 1 значення функції ![]() , що задаються числом τ, яке набуває двох значень: – j до +j. Правила відбору: Δj = 0, ±1. Дотримується правило неперетинання ліній підрівнів з одинаковим числом j.
, що задаються числом τ, яке набуває двох значень: – j до +j. Правила відбору: Δj = 0, ±1. Дотримується правило неперетинання ліній підрівнів з одинаковим числом j.
Для симетричних дзиг спостерігається двократне виродження по квантовому числу k. Для кожного j підрівнів 2j + 1. Перше число в індексі енергетичного рівня показує квантове число витягнутої дзиги, а друге – сплющеної. Наприклад, 202 – j = 2; k–1 = 0; k+1 = 2. Індекси –1 і +1 є параметрами Х. Повне: ![]() ; τ = k–1 – k+1 .
; τ = k–1 – k+1 .
Коливання молекул. Коливні спектри . Коливні спектри молекул вивчаються методами інфрачервоної спектроскопії. Ці спектри зв’язані з переходами між коливними енергетичними станами або з класичної точки зору з коливанням атомних ядер відносно рівноважних положень. Число і частоти смуг залежать від числа атомів, що входять до складу молекули, від мас ядер, від геометрії і симетрії молекул і від потенціального поля внутрімолекулярних сил. Інтенсивність спектра визначається дипольним моментом і поляризуємістю. По коливним спектрам спектрам проводять структурні дослідження, визначають симетрію молекули та наявність тих чи інших функціональних груп.
Коливні спектри молекул . Коливні спектри можна вивчати для речовин в будь-якому агрегатному стані – твердому, рідкому чи газоподібному. При розгляді коливного руху молекул в спектроскопії широко використовується поняття про криві потенціальної енергії – u(r). Слід підкреслити, що для коливного руху ядер роль потенціальної енергії відіграє повна (тобто потенціальна і кінетична) енергія електронів. При зміщенні ядер положення рівноваги сили хімічного зв’язку намагаються вернути їх у вихідне положення. Оскільки хімічний зв’язок визначається рухом електронів, то природно, що сила, яка повертає ядро у вихідне положення виникає за рахунок зміни повної енергії електронів, яка обумовлюється зміною взаємного положення ядер, для яких в свою чергу вказана енергія має зміст потенціальної енергії u(r).