Контрольная работа: Обертові, коливні і електронні спектри молекул
Якщо молекула містить N атомів, то загальне число незалежних координат, що характеризує положення ядер рівне 3N. Загальне число (3N) незалежних змінних зменшують на три і одержують (3N – 3). Число 3 описує координати центра ваги молекули. Тоді коливний рух багатоатомної молекули, що не має лінійної будови буде: 3N – 6, а для лінійної: 3N – 5. Наприклад, для двохатомної молекули (N = 2), яка є найпростішим випадком лінійної молекули, одержимо: 3N – 5 = 3 · 2 – 5 = 1, тобто молекула характеризується одною коливною координатою; для лінійної трьохатомної молекули (наприклад, СО2 ) одержуємо: 3N –5 = 3 · 3 – 5 = 4 (чотири коливні координати).
Питання про аналітичний вираз для кривих u(r) досить складне. Разом з тим відомо, що ці криві володіють мінімумом при r = rе і у випадку малих коливань (g = r – rе ) її можна представити у вигляді U (r – rе ) = Ug = k![]() , де k – коефіцієнт квазіпружної сили. З цього рівняння слідує, що при невеликих зміщеннях ядер з положення рівноваги реальна крива u(r) є параболою і відповідає коливанню гармонійного осцилятора з приведеною масою М з частотою коливання n0 . n0 =
, де k – коефіцієнт квазіпружної сили. З цього рівняння слідує, що при невеликих зміщеннях ядер з положення рівноваги реальна крива u(r) є параболою і відповідає коливанню гармонійного осцилятора з приведеною масою М з частотою коливання n0 . n0 = ![]() – цей вираз дозволяє визначити власну частоту гармонічного осцилятора для двохатомної молекули.
– цей вираз дозволяє визначити власну частоту гармонічного осцилятора для двохатомної молекули.
З розв’язку рівняння Шредінгера енергія гармонічного осцилятора квантується і визначається слідуючою формулою
Екол . v = ![]() hn0 ,
hn0 ,
v – коливне квантове число, яке набуває значення 0, 1, 2, 3…. Даному виразу енергії відповідає система рівновіддалених рівнів енергії, віддаль між якими складає hn0 .
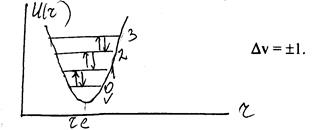
Спектр гармонічного осцилятора складається з одної лінії або смуги на частоті n0 – що є власною частотою гармонічного осцилятора.
При значних амплітудах коливання ядер двохатомну молекулу уже не можна розглядати як гармонічний осцилятор. Реальні коливання в цьому випадку стають ангармонічними. Зрозуміло, що в цих випадках необхідно розглядати загальний вигляд функції U(r) для широких значень r. Одним з найбільш відомих виразів для U(r) є формула Морзе U (r – rе ) = D [1 – ![]() ], a – стала, що характеризує форму кривих; D – енергія дисоціації молекули; е – основа натурального порядку; k – коефіцієнт квазіпружних сил. Знаючи n0 і D можна знайти форму потенціальної кривої Морзе:
], a – стала, що характеризує форму кривих; D – енергія дисоціації молекули; е – основа натурального порядку; k – коефіцієнт квазіпружних сил. Знаючи n0 і D можна знайти форму потенціальної кривої Морзе:
k = 2Da2 ; a = 2pn0 ![]() .
.
При невеликих значеннях (r – rе ) рівняння Морзе можна переписати у вигляді U (r – rе ) = Da2 (r – rе )2 , тобто для малих коливань формула Морзе автоматично переходить у рівняння параболи.
Потенціальній кривій, що описується рівнянням Морзе, відповідає квантове значення повної коливної енергії ангармонічного осцилятора:
Екол = ![]() hn0 –
hn0 – ![]()
![]() ,
,
v – коливне квантове число = 0, 1, 2, 3.
Енергетичні рівні ангармонічного осцилятора утворюють систему рівнів, які із зростанням v зближуються і накінець зливаються при Екол. v ® D. Правила відбору для ангармонічного осцилятора: Δv = 1, 2, 3, тобто у цьому випадку можливі переходи між будь-якими рівнями.
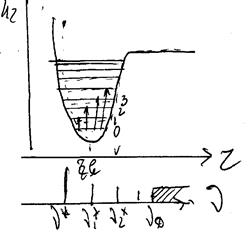
Перша смуга переходу (v = 0 ® v = 1) носить назву основної, або фундаментальної і має частоту n*, друга смуга ![]() (перехід v = 0 ® v = 2) називається першим обертом і характеризується частотою
(перехід v = 0 ® v = 2) називається першим обертом і характеризується частотою ![]() » 2n*. Третя смуга (другий оберт)
» 2n*. Третя смуга (другий оберт) ![]() » 3n*.
» 3n*.
Приймаючи до уваги, що частота будь-яких переходів визначається загальною формулою ![]() , де v¢ і v² – коливні квантові числа комбінуючих рівнів, одержимо:
, де v¢ і v² – коливні квантові числа комбінуючих рівнів, одержимо:
n* = n0 (1 – 2х),
![]() = 2n0 (1 – 3х),
= 2n0 (1 – 3х),
![]() = 3n0 (1 – 4х),
= 3n0 (1 – 4х),
де n0 – гармонічна частота c = ![]() .
.
Обертово-коливні спектри двохатомних молекул . Раніше при розгляді коливних переходів у двохатомних молекулах не враховувались ті обставини, що кожен коливний стан ізольованої молекули характеризується своєю системою обертових підрівнів. В загальному випадку положення енергетичних рівнів двохатомної молекули, що одночасно здійснює обертовий і коливний рух визначається виразом:
Еj , v = 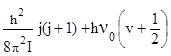
Або
Еj , v = ![]() ,
,
де В-обертова постійна;
j – обертове квантове число;
n0 – частота коливання;
v – коливне квантове число.