Контрольная работа: Обертові, коливні і електронні спектри молекул
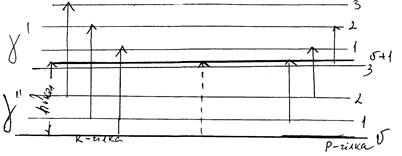
Мал. Схематичне зображення обертово-коливних переходів двохатомних молекул.
В даній системі рівнів можливі дві групи переходів, що супроводжуються збільшенням Δj = ±1, або зменшенням Δj = –1 обертового квантового числа. Переходи, для яких Δj = ±1 утворюють так звану R-гілку обертово-коливного спектру, а переходи, для яких Δj = –1 утворюють Р-гілку цього спектру.
Чисто коливний перехід (Δj = 0) є забороненим (пунктирна лінія). Слід відмітити, що характерні обертово-коливні спектри виникають тільки у випадку дослідження розрідження газів.
Коливання багатоатомних молекул . Коливання двохатомної молекули можна розглядати як коливання одиничного гармонічного або ангармонічного осцилятора з приведеного масою М і квазіпружного постійного k. На відміну від цього уже трьохатомна молекула володіє не одною, а кількома коливними степенями волі. У зв’язку з цим коливний спектр багатоатомної молекули містить цілий набір ліній і полос, частоти і інтенсивності яких відображають всі особливості її складного обертово-коливного руху. Як було показано раніше, чисдл коливних ступенів волі для лінійної молекули рівне 3N – 5, а для молекули будь-якої геометричної конфігурації 3N – 6, де N – число атомів у молекулі (кожна молекула характеризується трьома поступальними і трьома обертовими степенями волі.
Задача про коливний рух багатоатомної молекули – це задача про відносний рух її атомів, який не супроводжується переміщенням молекули в просторі і обертанням як цілої частини. Оскільки коливання окремих атомів в молекулі зв’язані один з одним, то таку задачу можна розглядати як складний коливний рух у вигляді суперпозиційних коливань цілого набору зв’язаних осциляторів. Розв’язання цього питання починається з вибору вихідної системи координат, в якій розглядається взаємне переміщення часток, що утворюють молекулу. Найбільш зручною координатною системою є система координат, яка задається розміщенням атомів у молекулі і характеризується значеннями довжин зв’язків і кутів між зв’язками. У зв’язку з цим природними коливними координатами називають зміну довжини зв’язків і валентних кутів при відповідних коливаннях. Так, наприклад, природними координатами молекули Н2 О є довжини зв’язків О–Н (r1 і r2 ) і величина кута між цими зв’язками j. При цьому коливними координатами служать q1 , q2 і q3 , що характеризують зміну вказаних природних координат:
q1 = r1 – r1 e ;
q2 = r2 – r2 e ;
q1 = j – je ,
де r1 e , r2 e і je – рівноважні значення природних координат.
Загальне число коливних координат (q) рівне числу коливних ступенів волі ρ = 3N – 6 (або 3N – 5) для лінійних молекул.
Основна задача, яка стоїть при розгляді коливного руху багатоатомної молекули полягає в тому, щоб виразити повну енергію Екол коливного руху, яка є сумою кінетичної Екін і потенціальної енергії Еп енергій через природні коливні координати, маси часток і квазіпружні постійні.
Енергія збудження, що попадає на один із осциляторів, на окремий хімічний зв’язок в молекулі перерозприділяється через деякий час на інші зв’язки, тобто всі атоми і хімічні зв’язки починають коливатися. Моделью таких коливань є коливання двох зв’язаних маятників. Такі маятники мають одинакову частоту коливання, причому прийнято вважати, що кожен з маятників ізольовано коливається як гармонічний осцилятор. Якщо такі маятники з’єднати пружною ниткою, то вони будуть взаємодіяти і кожен з маятників при цьому не буде коливатись незалежно. Обидва з’єднані маятники повинні розглядатись як спільна система, що виконує складний коливний рух. Цей складний рух двох маятників можна представити як накладання двох таких коливань, одне з яких має меншу, а друге – більшу ніж початкова частота коливання окремих, незв’язаних маятників.
Коливання, на які можна розкласти коливання зв’язаної системи, і при яких всі частки системи коливається з одною і тою ж частотою і фазою, тобто одночасно проходять через свої крайні положення, називають нормальними коливаннями.
Коливання, що мають більшу частоту ніж частота ізольованого маятника називають симетричним.
Коливання з меншою частотою називають антисиметричні. Кожна нормальне коливання молекули проходить з певною частотою nI , де i = 1, 2, …, r; r = 3N – 6 або 3N – 5 для лінійної молекули; N – число атомів у молекулі. Число коливних координат хλ , що визначає зміщення часток з положення рівноваги рівня r. Прикладом нормальних коливань можуть служити симетричні і антисиметричні коливання лінійної молекули СО2 , у якій при рівноважній конфігурації атоми оксигену розміщуються на одинаковій віддалі ρ0 від карбону (мал.).
0 С 0
·¾¾·¾¾· – рівноважна конфігурація
ρ0 ρ0 молекули СО2 .
0 С 0
¬·¾¾·¾¾·® – q1 і q2 – зміна довжин зв’язку
ρ1 = ρ0 +q1 ρ2 = ρ0 +q2 С–О; q1 = q2 .
Коливання симетричне, проходить з частотою n1 . Всі зв’язки одночасно скорочуються і видовжуються.
0 С 0
·®¾·¾¾·® – q1 ¹ q2 , при цьому коливанні один
ρ1 = ρ0 –q1 ρ2 = ρ0 +q2 . хімічний зв’язок скорочується, аінший видовжується.
Таке коливання називається антисиметричним.
В наближенні малих коливань енергія квантується незалежно для кожного нормального коливання і рівна ![]() (ni – частота даного нормального коливання; vi – відповідне коливне квантове число). Повна коливна енергія рівна
(ni – частота даного нормального коливання; vi – відповідне коливне квантове число). Повна коливна енергія рівна ![]() = =
= = 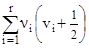 , а відповідна нульова енергія коливань Е0 =
, а відповідна нульова енергія коливань Е0 =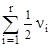 . Найпростіший збуджений коливний стан молекули одержиться, коли vj = 1, a vi = 0; i ¹ j. Енергія такого стану рівна
. Найпростіший збуджений коливний стан молекули одержиться, коли vj = 1, a vi = 0; i ¹ j. Енергія такого стану рівна
E01 = 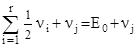 .
.