Курсовая работа: Формирование и развитие химических понятий при изучении темы: "Электролиз растворов и расплавов"
а) восстановление ионов Na+ до металлического натрия (катодный процесс).
б) окисление ионов Cl- до газообразного хлора (анодный процесс).
|
NaCl Ї | ||
| (-) K | ¬ Na+ + Cl- ® | A (+) |
Суммируя уравнения катодного и анодного процессов, (с учетом электронного баланса) получим окислительно-восстановительную реакцию, протекающую при электролизе:
2NaCl = 2Na(ж) + Cl2(г)
Задания на закрепление материала
Задание 1. Составьте схему электролиза расплава бромида натрия.

Задание 2. Составьте схему электролиза расплава сульфата натрия.

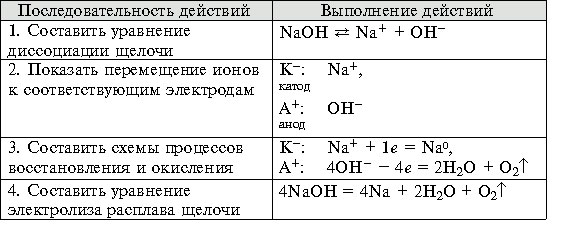
Электролиз расплавов щелочей.
Задание 3. Составьте схему электролиза расплава гидроксида натрия. [3,4]
3. МЕТОДИЧЕСКИЕ ОСОБЕННОСТИ ИЗУЧЕНИЯ ТЕМЫ: «ЭЛЕКТРОЛИЗ РАСТВОРОВ И РАСПЛАВОВ
Урок по теме: Электролиз"
Проверка, корректировка и углубление знаний учащихся по теме «Электролиз» через эксперимент и решение задач. - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти.
Оборудование: компьютер, медиапроектор, кодоскоп, мультимедиа учебный курс «1 С: Образовательная коллекция. Общая и неорганическая химия 10-11 классы» (или таблица «Получение алюминия в промышленности»), презентация к уроку, источник питания на 4 В, раствор сульфата меди (II), прибор для проведения электролиза, лабораторные амперметры, ключи, реостаты, соединительные провода, зажимы, карточки с заданиями, текстами задач.
Ход урока
I. Организационный этап. (2-3 минуты) (слайд 1 приложения № 5)
Учитель химии: Здравствуйте, на прошлом уроке мы теоретически рассмотрели процессы, проходящие при электролизе. Сегодня продолжим изучение темы «Электролиз», практически применяя знаний. Закрепим умения: составлять уравнения химических реакций процессов, проходящих при электролизе расплавов и растворов электролитов; проводить расчеты по реакциям и с помощью законов Фарадея; практически проводить электролиз раствора. Будьте внимательны, активны, организованны. За практическое занятие вы получите итоговую оценку, основными показателями качества вашей работы будут четкость и глубина ответов, аккуратность выполнения эксперимента, правильное решение задач, выполнение домашнего задания (слайды 2,3).
II. Проверка домашнего задания.(15 минут)
Учитель физики: У доски работают 4 учащихся. Задания:
1 учащийся – вывести формулу заряда электрона,2 учащийся- написать уравнения электролиза раствора серной кислоты.3 учащийся- написать уравнения электролиза раствора хлорида ртути (II),4 учащийся- написать уравнения электролиза раствора фторида калия.
Остальные учащиеся пишут в тетрадях уравнения процессов, проходящих при электролизе раствора хлорида бария (один учащийся пишет эти уравнения на пленке для кодоскопа с последующей проверкой).Учитель химии контролирует работу учащихся у доски, учитель физики, проходя по классу, проверяет домашнее задание у каждого учащегося и фиксирует это в листе «Результатов и достижений учащихся».
III. Исследовательский этап. (25 минут)
Лабораторный эксперимент
Учитель физики: Ребята, для вас приготовлен раствор сульфата меди (II) (слайды 4,5) Выполните следующее задание: пропустите электрический ток через раствор медного купороса и определите, как изменится масса меди (судить по показаниям амперметра), выделившейся на катоде за один и тот же небольшой промежуток времени, при изменении условий, указанных в картах-заданиях (Приложение 1).
Внимание:
1. На начало опыта электроды должны быть погружены в раствор наполовину.
2. Сделать отчет по форме:
а) запись уравнения реакции;