Курсовая работа: Формирование и развитие химических понятий при изучении темы: "Электролиз растворов и расплавов"
в) полученный результат.
Перед проверкой выполненного каждой группой учащихся лабораторного эксперимента учитель физики на одной из опытных установок (на первой парте, например) меняет полюса подключения источника тока к угольным электродам, предварительно показав катод всем учащимся, обратив внимание на его характерную окраску. Поочередно спрашивает результат, полученный каждой группой при выполнении эксперимента. Затем включает кодоскоп, и учащиеся сравнивают свои результаты с записями на пленке кодоскопа, записывают общий вывод в тетрадь:
масса вещества выделяемого на электродах зависит от напряжения, концентрации раствора, температуры, расстояния между электродами, площади электродов (слайд 6)
Учитель химии: Вы экспериментально подтвердили, что с помощью электролиза можно получать разные вещества, в частности, медь. В промышленности электролизом получают и другие металлы, например алюминий.Далее следует сообщение учащегося о получении алюминия в промышленности (приложение 2).
Демонстрационный эксперимент
Учитель физики: посмотрим на результат нашего эксперимента по замене полярности угольных электродов. (Отключает установку и достает электрод, который был покрыт медью. Учащиеся убеждаются, что электрод стал чистым). Формулируется вывод: медь, осевшая на катоде, прореагировала, когда он стал анодом.
Вопрос: Что произойдет, если анод будет из меди?
Учитель химии: Тогда процессы для раствора сульфата меди (II) будут следующими (слайд 8):
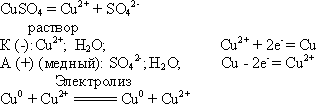
Учащиеся записывают все в тетрадь. Учитель сообщает, что электролиз с растворимым анодом применяют для очистки металлов. Этот способ называется электролитическим рафинированием (приложение 3).
IV. Решение задач. (10 минут)
Учитель физики: переходим к следующей части занятия – решению задач. Вызывает к доске двух учащихся, которые решают задачи: № 1 и №2. Остальные учащиеся решают задачу № 3 в тетради (приложение 4).Один из учащихся решает задачу № 3 на пленке кодоскопа для последующей проверки.
После разбора задач-примеров, решенных на доске и задачи на пленке кодоскопа, учащимся предлагается выполнить самостоятельную работу по решению задач (уровень сложности задачи ученик может выбрать сам (приложение 4)
V. Самостоятельная работа. (25 минут) (приложение 4)
VI. Подведение итогов урока. (8 минут)
Учитель физики проводит собеседование с учащимися по вопросам (слайд 9):
-что сделано?
-что повторили?
-что узнали нового?
Далее выставляется итоговая оценка каждому учащемуся в лист «Результатов и достижений учащихся».
VII. Домашнее задание. (2 минуты)
Учитель химии комментирует домашнее задание.
Литература к уроку:
1. Касьянов В.А. Физика. 11 кл.: Учебник для общеобразоват. учреждений. - М.: Дрофа, 2007.
2. Рымкевич А.П. Физика. Задачник. 10-11 кл.: Пособие для общеобразоват. учеб. заведений. - М.: Дрофа, 2004.
3. Общая химия: учебник для 11 кл. общеобраз. учреждений с углубл. изуч. химии/ Габриелян О.С.и др. - М: Просвещение ,2006.
Урок 2. «Электролиз»
Цели:
- дать представление об электролизе как окислительно-восстановительном процессе;