Курсовая работа: Молибден
Химический элемент № 42, Мо
ЗАДАНИЕ.
4. Электронное строение атома.
4.1. Составьте электронную формулу данного элемента.
4.2. Дайте объяснение физического смысла всех индексов у данного химического элемента в системеД.И. Менделеева (порядковый номер, номер периода, номер группы, принадлежность к группе «А» или «Б»). Определите возможность «Эффекта провала электрона».
4.3. Выделите валентные подуровни в электронной формуле атома химического элемента, определитепринадлежность химического элемента к типу s-, p-, d-, f-элементов.
4.4. Напишите наборы квантовых чисел для всех валентных электронов.
4.5. Определите принадлежность химического элемента к металлам или неметаллам, спрогнозируйтевеличины степени окисления.
4.6. Распределите валентные электроны атома химического элемента по энергетическим ячейкам в соответствии с принципом наименьшей энергии и правилом Гунда.
4.7. Прогнозируйте тип гибридизация валентных атомных орбиталей при образовании бинарных соединений (фторидов, хлоридов и др.).
5. Соединение данного химического элемента с неметаллами.
5.1. С водородом.
5.2. С галогенами.
5.3. С серой.
5.4. С азотом.
5.5. С углеродом.
5.6. С кислородом.
6. Оксиды и гидроксиды данного химического элемента.
6.1. Запишите ряд оксидов данного химического элемента (прогноз по электронной формуле иковалентности).
6.2. Прогнозируйте характер оксидов (основной, кислотный, амфотерный) по величине Э.О. и правилухимических свойств ряда оксидов.
6.3. Запишите соответствующие гидроксиды (основания и кислоты). Определите принадлежность к сильнымили слабым электролитам.
6.4. Составьте уравнения реакций, подтверждающих характер гидроксидов о молекулярном и ионном виде.
6.5. Напишите уравнения реакций электролитической диссоциации гидроксидов.
7. Может ли данный химический элемент образовывать комплексные соединения? Если да, то, какие (кислоты, основания, соли)? Приведите примеры.
8. Напишите уравнения реакций гидролиза соли ![]() по 1-ой стадии в молекулярном и ионном виде с учетом всех равновесий. Рассчитайте рН среды при гидролизе этой соли (0 ,01 моль/л). Как усилить гидролиз?
по 1-ой стадии в молекулярном и ионном виде с учетом всех равновесий. Рассчитайте рН среды при гидролизе этой соли (0 ,01 моль/л). Как усилить гидролиз?
9. Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Мо и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН<7. 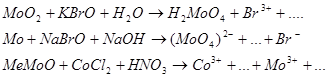
Предварительно рассчитайте Е0 химической реакции, используя метод электронно-ионного баланса.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--