Курсовая работа: Молибден
МоО3 характерен гидрат состава Н2 МоО4 и Н2 МоО4 ×Н2 О. Н2 МоО4 - белые мелкие кристаллы гексагональной формы. Дигидрат Н2 МоО4 ×Н2 О образуется при стоянии подкисленного раствора молибдатов в течении нескольких недель, а также при внесении затравки Н2 МоО4 ×Н2 О в сильно подкисленный раствор парамолибдата аммония. Н2 МоО4 - молибденовая кислота, кислота средней силы, например, она более сильная чем угольная кислота и вытесняет ее из ее солей:
![]()
Гидраты окислов с валентностью металла между VI и IVполучены в виде соединений МоО(ОН)3 и Мо(ОН)5 . сила этих электролитов очень слабая, они малорастворимы в воде.
МоО2 характерен гидрат состава Н2 МоО3 , который в свободном состоянии не выделен, выделен только в растворах, также получены его соединения состава Ме2 МоО3 .слабый электролит.
Также при действии аммиака на растворы молибдатов получен Мо(ОН)3 - аморфный порошок черного цвета, не растворим в воде и растворах щелочей, легко растворяется в минеральных кислотах и при отсутствии окислителей дает ионы Мо+3 .
6.4. Составьте уравнения реакций, подтверждающих характер гидроксидов о молекулярном и ионном виде.
Рассмотрим свойства Н2 МоО4
Молибденовая кислота реагирует при повышенной температуре с оксидами, гидроксидами, карбонатами щелочных и щелочноземельных металлов давая соответствующие молибдаты.
![]()
![]()
![]()
![]()
![]()
![]()
Состояние молибденовой кислоты в растворах зависит от кислотности и разбавлености последних. При большом разбавлении (<10-4 моль/л, РН>6,5) молибденовая кислота находится в растворе в виде простых молекул. В более концентрированных растворах и при РН меньше шести: РН<6 происходит полимеризация молекул. Степень сложности образованных комплексов также зависит от температуры.
Рассмотрим свойства Мо(ОН)3
Сухой Мо(ОН)3 - это аморфный порошок, не растворимый в воде и растворах щелочей. Он проявляет основные свойства. Легко растворяется в растворах минеральных кислот, при этом образуются соли Мо3+ .
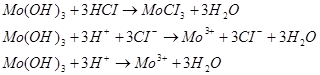
6.5. Напишите уравнения реакций электролитической диссоциации гидроксидов.
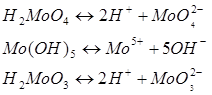
7. Может ли данный химический элемент образовывать комплексные соединения? Если да, то, какие (кислоты, основания, соли)? Приведите примеры.
8. Напишите уравнения реакций гидролиза соли ![]() по 1-ой стадии в молекулярном и ионном виде с учетом всех равновесий. Рассчитайте рН среды при гидролизе этой соли (0 ,01 моль/л). Как усилить гидролиз?
по 1-ой стадии в молекулярном и ионном виде с учетом всех равновесий. Рассчитайте рН среды при гидролизе этой соли (0 ,01 моль/л). Как усилить гидролиз?
Гидролиз солей молибдена (IІI) протекает ступенчато, в основном, по первой ступени.
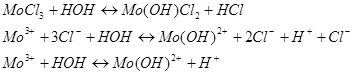
Как видно из записи уравнения гидролиза ![]() РН раствора будет кислым, поскольку будут синтезироваться ионы водорода.
РН раствора будет кислым, поскольку будут синтезироваться ионы водорода.
Для гидроксида молибдена ![]() ПР =
ПР = ![]() , поскольку он не растворим в воде.
, поскольку он не растворим в воде.
![]()
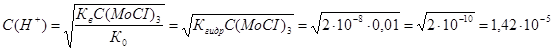
Тогда РН раствора при гидролизе будет равен: ![]() . Но мы нашли концентрацию ионов водорода в растворе, поэтому:
. Но мы нашли концентрацию ионов водорода в растворе, поэтому: ![]() .
.