Курсовая работа: Редкоземельные металлы и их полуторные оксиды
Научный руководитель
Доцент кафедры
Балабаева Р.Ф.
Студент группы Ф-51В
Туркина А.Н.
Ярославль 2009 г.
ОГЛАВЛЕНИЕ
1. Введение
2. Редкоземельные элементы
2.1 Европий
3. Влияние условий получения полуторных оксидов РЗЭ на их кристаллическое строение
3.1 Окисление металлов
4. Фазовые превращения полуторных оксидов РЗЭ
4.1 Необратимые или медленно протекающие фазовые превращения
4.2 Обратимые полиморфные превращения
4.3 Влияние давления на полиморфизм оксидов
5. Простые оксиды европия
6. Устойчивость полуторных оксидов РЗЭ
7. Стабилизация метастабильных форм полуторных оксидов РЗЭ
8. Заключение
9. Список литературы
1. ВВЕДЕНИЕ
Редкоземельные элементы (в минералогии — TR, от лат. terra rará), химические элементы побочной подгруппы III группы периодической системы Менделеева: скандий Sc (атомный номер Z = 21), иттрий Y (Z = 39), лантан La (Z = 57) и лантаноиды (14 элементов, Z от 58 до 71). Sc, однако, не всегда относят к редкоземельным элементам. В свободном виде — металлы. Название «редкоземельные» дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре и, во-вторых, образуют тугоплавкие, практически не растворимые в воде оксиды (такие оксиды в начале 19 в. и ранее назывались «землями»). Важная особенность редкоземельных элементов — их совместное нахождение в природе. Например, минерал монацит — один из основных источников этих элементов — содержит фосфаты Y, La и др. Подразделяются на иттриевую (Y, La, Gd-Lu) и цериевую (Се-Eu) подгруппы. Элементы Се-Eu называют легкими, a Cd-Lu-тяжелыми лантаноидами.
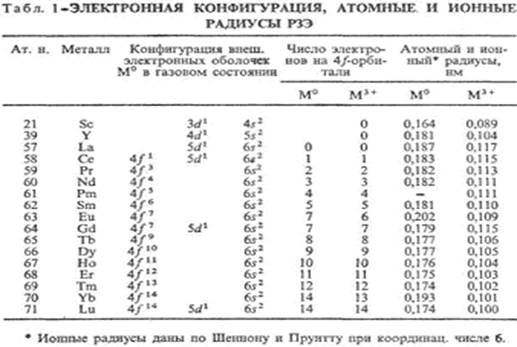
Электронная структура, лантаноидное сжатие, электронная конфигурация РЗЭ дана в табл. 1, у ионов М3+ (М = Sc, Y, La) устойчивая конфигурация инертных газов. У Sc, Y и La в образовании химической связи участвуют d- и s -электроны, у других РЗЭ могут участвовать также f -электроны, однако близкие химические свойства РЗЭ определяются главным образом внешними d- и s -электронами. Поэтому эти элементы объединены в одну группу.
В состоянии М3+ РЗЭ имеют оболочку с 4f n -электронами (кроме Sc), в газовом состоянии-4f n+ 1 6s 2 (кроме La, Ce, Gd и Lu, имеющих оболочку 4f n ), в металлическом М°-4f n (для Еu и Yb-4f n + 1 ). Предполагается, что вакантная, заполненная наполовину и заполненная полностью f -оболочки обладают повышенной устойчивостью. Поэтому Sc, Y, La, Gd и Lu образуют только ионы М3+ , для Се и Тb устойчиво также состояние М4+ , а для Еu и Yb-также М2+ . Помимо электронной структуры на устойчивость валентных состояний РЗЭ влияют и другие факторы: например, ионы Sm+ , Tm+ (конфигурации f 7 и f 14 ), Рr5+ (f 0 ), Dy5+ (f 7 ) крайне неустойчивы.
2. Редкоземельные элементы
РЗЭ-элементы - металлы серебристо-белого цвета, некоторые с желтоватым оттенком (Рr, Nd). Они пластичны и электропроводны, легко поддаются механической обработке. Многие свойства простых веществ и соединений изменяются симбатно в рядах La-Eu и Gd-Yb. Особенно резко отличаются свойства, отражающие переход из связанного состояния в свободное и обратно.
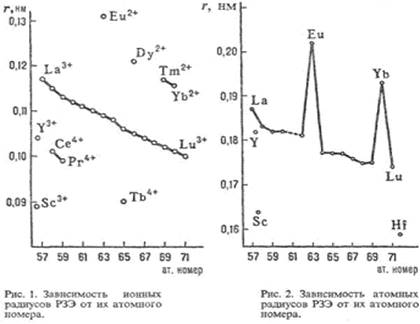
Например, при переходе из металлического состояния в парообразное мерой является давление пара металлов. При 25 °С давления паров РЗЭ различаются более чем на 40 порядков, а при 1000 °С - примерно на 10 порядков (минимальное давление характерно для La, Gd и Lu, максимальное - для Еu и Yb). Это связано с большой разницей в энергии, необходимой для перехода 4 d -электрона на 5d -уровень. С другой стороны, есть свойства, остающиеся примерно постоянными для всех РЗЭ. Вследствие лантаноидного сжатия при переходе от La к Lu ионные радиусы РЗЭ и их атомные радиусы (кроме Еu и Yb) плавно уменьшаются (рис. 1, 2), плотность простых веществ увеличивается [31].
2.1 Европий
Европий - это химический элемент, находящийся в третей группе периодической системы Менделеева и относящийся к лантаноидам. Его атомный номер 63, атомная масса 151.96. Мягкий металл, серебристо-белого цвета, плотностью 5.2456 г/см3, температура плавления = 8260 С. По твердости европий очень похож на свинец- такой же мягкий и пластичный.
Европий - самый легкий из лантаноидов, и самый неустойчивый среди редкоземельных элементов - в присутствии кислорода воздуха и влаги быстро окисляется (корродирует).
В природе европий - малораспространенный элемент, даже среди редкоземельных элементов европий - один из самых редких, а потому и наиболее дорогих. В свободном виде не встречается, входит в состав таких минералов, как монацит (обезвоженный фосфат редкоземельных элементов цериевой группы - (Ce,La,Y,Th)PO4 ), бастнезит и других содержащих редкоземельные элементы минералов. В природные воды европий попадает в районах залегания пород, содержащих редкоземельные элементы, в результате его реакции с водой.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--