Отчет по практике: Влияние витаминов группы В на ход технологического процесса при производстве йогурта
Витамин В2 (рибофлавин) широко распространен в природе. Из растительных продуктов им наиболее богаты пекарские и пивные дрожжи и бобовые, из животных продуктов − мясо, печень, почки и сердце, коровье молоко, яйца. В животных и растительных продуктах рибофлавин встречается реже в свободном виде и чаще − в связанном, в виде коферментов: рибофлавин-мононукдеотида и рибофлавин-адениндинуклеотида. Рибофлавин представляет собой производное изоаллоксазина, связанного с сахарным спиртом (рибитилом), имеющим 5 углеродных атомов (рис. 1)
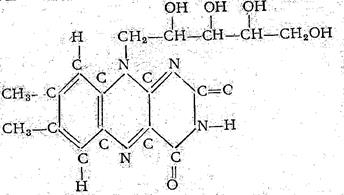
Рис. 1
Молекулярный вес рибофлавина 374,4. Максимумы поглощения при 223, 263, 268, 359-372, 445, 475 ммк. Это тонкие оранжево-желтые кристаллы, горькие на вкус, растворимые в воде и спиртах, нерастворимые в растворителях жиров. Рибофлавин теплоустойчив в сухом виде и в кислых растворах и неустойчив в щелочных растворах, а также к свету.[4]
Аналогами-антагонистами рибофлавина являются диэтилфлавин, изорибофлавин, противомалярийный препарат атебрин и др. В организме рибофлавин действует в составе уже упомянутых выше коферментов: рибофлавин-мононуклеотида и рибофлавин-адениндинуклеотида, которые, соединяясь с белками или с минеральными элементами (магнием, железом, медью и молибденом), в виде цитохром-редуктаз, оксидаз, дегидрогеназ и диафораз активно участвуют как переносчики водорода в целом ряде ферментных реакций промежуточного обмена, осуществляя окислительное фосфорилирование в дыхательной цепи.[3]
В большинство этих ферментов входит рибофлавин-адениндинуклеотид и в меньшинство − флавин-моионуклеотид. Входя в различные аминокислотные оксидазы, рибофлавин также необходим для правильного обмена белков. Он проявляет стимулирующее процессы анаболизма действие в зависимости от содержания белков в пище.
Витамин В2 влияет на рост и развитие плода. Недостаток его во время беременности может привести к недонашиванию плода и его уродствам. Рибофлавин вместе витамином А и амидом никотиновой кислоты участвует в акте светового и цветового зрения и обладает экранирующим действием на глаз, предохраняя его от вредного влияния ультрафиолетовых лучей.
При экзогенной и эндогенной недостаточности в рибофлавине плохо заживают раны и трофические язвы, а также трещины сосков у женщин. Недостаточность рибофлавина чаще всего встречается наряду с дефицитом животного белка и никотиновой кислоты.
Наиболее частыми симптомами недостаточности рибофлавина являются изменения со стороны слизистой оболочки рта, кожи и глаз. Наиболее ранний симптом − поражение слизистой в углах рта с образованием трещин, эрозий и язв: так называемый ангулярный стоматит, или «заеды» (старое русское название). Затем возникают поражения слизистой губ на месте их смыкания, приводящие к вертикальным трещинам - хейлоз, изменения слизистой оболочки языка, который становится пурпурно-красным с мелкозернистой поверхностью − глоссит. Наряду с этим отмечаются себорейный дерматит кожи лица, ушей, груди, заболевания глаз: блефарит, конъюнктивит иваскуляризирующий кератит со слезотечением, жжением и светобоязнью.[5]
Эндогенная недостаточность рибофлавина встречается при заболеваниях желудочно-кишечного тракта, гепатитах, болезнях кожи. Рибофлавин нетоксичен.
Витамин В6 встречается в природе в трех видах: пири-доксин, пиридоксаль, пиридоксамин. В небольших количествах он широко распространен в растениях, в значительных − в животных продуктах. Из растительных продуктов хорошими его источниками являются сухие пивные дрожжи, пшеничные отруби, пшеница, ячмень, просо, кукуруза, бобовые; из животных продуктов − говядина, говяжья печень, почки, телятина, свинина, баранина, сыр, треска, лососина, тунец.
Химическое строение витаминов группы В6 следующее (рис. 2):
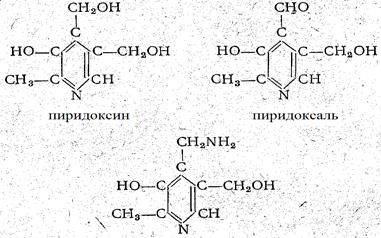
Рис. 2
Молекулярный вес пиридоксина 169,2. Максимум поглощения при рН 2,1-291 ммк, рН 6,6-255-324 ммк, при рН 10-247 и 310 ммк. Пиридоксин хлоргидрат представляет собой бесцветные призмы, легко растворимые в воде и спирте, устойчивые к нагреванию, к кислотам и щелочам, но неустойчивые к свету. Молекулярный вес пиридоксаля 167,2; спектры поглощения такие же, как и у пиридоксина; неустойчив к нагреванию. Молекулярный вес пиридоксамина 183,2. Это бесцветные кристаллы, неустойчивые к нагреванию. Аналогами-антагонистами пиридоксина являются 4-дезоксипиридоксин, токсипиримидин и изоникотинилгидразид.
Пиридоксин участвует в обмене веществ в фосфорилированном виде, в основном в виде кофермента пиридоксальфосфата (ПАЛФ), входящего в состав многих трансаминаз и декарбоксилаз, а также в состав кинурениназы, цистотианазы, серии- и треониндегидраз и др. Он играет весьма важную роль в синтезе таких коферментов, как НАД, НАДФ, коэнзим А и др., в синтезе серотоиина и γ-аминомасляной кислоты. Другие коферменты пиридоксина имеют гораздо менее широкий спектр действия.
Витамин В6 , по видимому, играет роль в обмене жира, так как при его недостатке нарушается превращение белков в жиры и образование эссенциальных полиненаеыщенных жирных кислот. При расщеплении пиридоксина в организме он в основном выделяется с мочой в виде 4-пиридоксиловой кислоты.
При недостаточности в пиридоксине у грудных детей наблюдаются эпилептиформные судороги и гипохромная микроцитарная анемия. Развитие В6 -недостаточности у взрослых усугубляется при действии аналогов-антагонистов пиридоксина. При этом наступает потеря аппетита, тошнота, беспокойство, раздражительность, сонливость, сухой себорейный дерматит лица, головы, шеи, груди, хейлоз, конъюнктивит, глоссит, психотические реакции. Вторичная (эндогенная) недостаточность витамина В6 была обнаружена при токсикозе беременных с повышенным выделением с мочой ксантуреновой кислоты и резким понижением выделения 4-пиридоксиловой кислоты после нагрузки триптофаном.[4]
Пиридоксин и пиридоксамин нетоксичны. Пиридоксаль обладает относительно высокой токсичностью.
Витамин В12 (кобаламин) в растительных продуктах практически отсутствует, но он синтезируется микроорганизмами. Хорошими его источниками являются мицелий ряда стрептомицетов, пропионовокислые и метанобразующие бактерии. Из животных продуктов он содержится в достаточных количествах в печени ряда рыб, крупного рогатого скота, свиней. В обычных условиях кобаламин синтезируется бактериями кишечной флоры в количествах, достаточных для организма.[2]
Витамин B12 , используемый человеком и животными, встречается в нескольких формах, химические и физические свойства которых практически одинаковы. Все эти соединения носят название «кобаламины». Наиболее типичный из них − цианокобаламин (рис. 3).
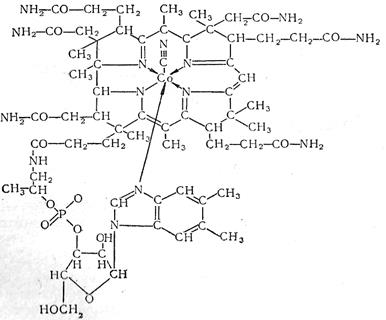
Рис. 3
Он включает рибозонуклеотидную часть, в которой вместо пурина и примидина в качестве основания содержится 5,6-диметилбензимидазол. Структурной основой цианокобаламина является макрокольцо из четырех пиррольных колец, сходных по строению с порфирином.
Атомы азота пиррольных колец и один из атомов азота бензимидазола связаны с атомом кобальта, который в свою очередь координационно связан с анионом − цианидным радикалом. Из 19 углеродных атомов, составляющих макрокольцо, у 13 водород замешен метальными группами или длинными боковыми цепями ацетамидных или пропионамидных радикалов. Молекулярный вес 1490±150. Максимумы поглощения при 278, 361 и 550 ммк. Темно-красные иглы или призмы без вкуса и запаха. Хорошо растворимы в воде и спирте. Нейтральные или слабокислые растворы стойки при комнатной температуре и в темноте. Свет, в особенности солнечный, разрушает витамин B12 . В водном растворе при рН от 4,0 до 6,0 витамин B12 практически не разрушается даже при автоклавировании при 120° в течение 15 минут.
Наряду с цианокобаламином выделены еще аквокобаламин, нитритокобаламин, имеющие основной характер, а также группа кислых кобаламинов. Из аналогов витамина B12 следует отметить фактор А, фактор В, псевдовитамин В12 и др.[4]
Поступающий в организм витамин B12 соединяется в тонких кишках с «интринзивным» (внутренним) фактором Касла, выделяемым железами дна желудка. Фактор Касла представляет собой гликопротеид-гастромукопро-теид, имеющий высокий молекулярный вес (40 000 − 70 000), сложного состава, включающий не менее 15 аминокислот, гексозамин, маннозу, галактозу и фруктозу. Механизм действия внутреннего фактора полностью еще не ясен. Он весьма сложен и, возможно, в нем участвует стенка кишечника. Роль этого фактора, по-видимому, заключается в связывании витамина B12 , предохранении его от использования кишечными бактериями и инактивации продуктами их обмена, а также в облегчении всасывания самого витамина. Из поступающего с пищей кобаламина всасывается очень ограниченное количество, несмотря на добавление гастромукопротеида.
Витамин B12 относится к веществам с весьма высокой биологической активностью. Основная роль его в обмене веществ полностью еще не раскрыта. Есть основание полагать, что благодаря своей нуклеотидной группе он выполняет главным образом коферментные функции и связывается со специфическими белками. Установлены роль витамина В12 в биохимических обменных реакциях, связанных с сульфгидрильными ферментными системами, участие его в синтезе лабильных метальных групп, в образовании метионина и холина, участие в синтезе нуклеиновых кислот, в частности пуриновых и пиримидиновых оснований. Участие кобаламина в их синтезе, а также в синтезе аминокислот, по-видимому, сопряжено с фолиевой кислотой. Витамин В12 способствует образованию тетрагидрофолиевой кислоты, а последняя в виде формильного производного осуществляет перенос одноуглеродного остатка, замыкая кольцо 4,5-амино-5,4-имидазолкарбоксамида. Таким образом, при недостаточности витамина B12 задерживается синтез ряда незаменимых аминокислот (метионина и др.), белков и блокируется синтез рибонуклеиновых кислот.[1]
Дефицит витамина В12 у человека наступает вследствие либо недостаточного получения его с пищей, либо недостаточного его всасывания в кишечнике. Алиментарная (экзогенная) недостаточность встречается в старческом возрасте при ограниченном потреблении мяса, рыбы, яиц и молочных продуктов, а также у лиц среднего возраста при строго вегетарианском питании. Недостаточностью витамина B12 эндогенного происхождения является пернициозная анемия, характеризующаяся мегалобластическим перерождением костного мозга, гиперхромной анемией, поражением языка (глоссит), слизистой оболочки рта, атрофией слизистой дна желудка и фуникулярным миелозом. Как уже указывалось, основной причиной пернициозной анемии является не столько недостаточное поступление в организм витамина В12 , сколько нарушение его использования в пищеварительном тракте. Для использования и всасывания витамина B12 необходимо наличие гастромукопротеида, который у больных пернициозной анемией не вырабатывается в организме вследствие атрофии желез дна желудка.[6]