Реферат: Ароматичні вуглеводні сполуки
–––––––- sp3-Гібридизований атом карбону
p-Комплекс s-Комплекс (аренонієвий катіон)
4 Повернення ароматичності. Оскільки втрата ароматичності енергетично невигідна, система прагне повернути її найпростішим шляхом, а саме – відщепленням протону Н+ від s-комплексу. Внаслідок цього два електрони, що утворювали зв¢язок С-Н, приєднуються до тих чотирьох p-електронів, які залишалися в s-комплексі. Тому замкнута шестиелектронна система поновлюється і молекула переходить в ароматичний стан:
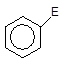 |
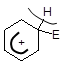 Швидко
Швидко
–––––––––- + H+.
s-Комплекс Продукт Протон
5 Утворення побічного продукту. Відщеплений протон взаємодіє з негативно зарядженим аніоном А-, що утворився при розриві зв¢язків у молекулі реагенту на перший стадії:
Н+ + А- –––––––- HA.
Побічний продукт
У загальному вигляді механізм реакції електрофільного заміщення в аренах можна зобразити схемою
 + Е+ Û –––-
+ Е+ Û –––-
Субстрат Електрофіл p-Комплекс
 –H+
–H+
–––> –––––––>
s-Комплекс Продукт
Розглянемо найважливіші реакції електрофільного заміщення SE.
1 Галогенування бензену проходить тільки за наявності каталізаторів – так званих кислот Льюїса (речовин, здатних зв¢язувати вільну електронну пару): AlCl3, FeCl3, AlBr3, FeBr3, SnCl4, TiCl4, BF3. Практичного значення набули реакції хлорування та бромування, тому що реакція з хімічно активним F2 проходить деструктивно, а з І2 – дає надзвичайно малий вихід завдяки низькій реакційній здатності йоду.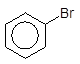

80о C
+ Br2 –––––- + HBr,
AlВr3
Бромбензен
![]()
25о C
+ Cl2 ––––––––- + HCl.
AlCl3
2 Нітрування. Бензен реагує дуже повільно навіть з концентрованою HNO3 при нагріванні, але при дії на нього нітрувальною сумішшю (суміш концентрованих HNO3 i H2SO4) досить легко перетворюється на нітропохідні.
Електрофільною частинкою є нітроїл-катіон NO2+, який утворюється під впливом сірчаної кислоти:
HO-NO2(к) + 2H2SO4 (к) Û 2HSO4- + H3O+ + NO2+,
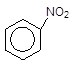 |
![]() 50о С
50о С
+ HO-NO2(к) --------- + H2O.