Реферат: Ароматичні вуглеводні сполуки
Малеїновий ангідрид і малеїнова кислота використовуються у виробництві поліестерних смол, склопластику і лакофарбових матеріалів.
У живих організмах бензен під дією ферментів окиснюється до дуже шкідливої сполуки – муконової кислоти:
 |
+ 2О2 –––––––- HOOC-CH=CH-CH=CH-COOH.
Бензен Фермент Муконова кислота
ВПЛИВ ЗАМІСНИКІВ НА РЕАКЦІЙНУ ЗДАТНІСТЬ АРОМАТИЧНИХ ВУГЛЕВОДНІВ
Найважливішим чинником, що визначає хімічні властивості речовин, є розподілення електронної густини в молекулах, яке залежить від взаємного впливу атомів і атомних груп. Якщо молекула містить тільки s-зв¢язки, взаємний вплив здійснюється через індуктивні ефекти, а в спряжених системах виявляється дія мезомерного ефекту.
Мезомерний ефект, або ефект спряження – це зміщення електронів, які утворюють p-зв¢язки спряженої системи, а також неподілених електронних пар атомів електронегативних елементів (0, S, N), що містяться у ланцюгу.
Замісники можуть виявляти позитивний мезомерний ефект (+М), якщо зміщують p-електронну густину від себе, і негативний мезомерний ефект (-М), якщо зміщення електронної густини відбувається у протилежному напрямку.
Одна і та сама група атомів може виявляти одночасно два електронних ефекти: мезомерний і індуктивний. Обидва ефекти можуть як збігатися, так і не збігатися за напрямком свого впливу. Наприклад, аміногрупа NH2 виявляє негативний індуктивний ефект (–І), тобто зміщує електронну густину σ-зв’язку на себе, і в той же час – позитивний мезомерний (+М), завдяки якому π-електронна густина спряженої системи зміщується від аміногрупи. Найчастіше вплив мезомерного ефекту перебільшує дію індуктивного.
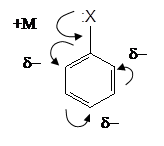
Молекула бензену – ця спряжена система з рівномірним і симетричним розподіленням шестиелектронної p-електронної хмари. Однак наявність у бензеновому кільці замісника призводить до певного перерозподілу електронної густини і, як наслідок, до зміни реакційної здатності сполуки. Тобто замісник виявляє орієнтуючу (спрямовуючу) дію при введенні у кільце ще одного, нового замісника.
За характером орієнтуючої дії замісники поділяються на два типи.
Замісники І роду (елек–тронодонорні), які підвищують електронну густину бензенового кільця (особливо в о- і n-положеннях) і збільшують швидкість реакцій електрофільного заміщення SE. Такі замісники називаються активуючими.
До них належать атоми і атомні групи з позитивним мезомерним (+М) чи індуктивним (+І) ефектом (табл. 2).
Оскільки електроно–донорний замісник утворює з кільцем загальну спряжену систему, то відбувається перерозподіл електронної густини таким чином, що найбільша її частина зосереджується в о- і n-положеннях на атомах С – з цієї причини їх часто називають орто- і параорієнтантами. За рахунок виникнення часткових негативних зарядів (d-) ці атоми карбону стають центрами електрофільної атаки. До того ж полярність зв¢язків С-Н в о- і n-положеннях збільшується, тому зростає рухливість атомів Н, що полегшує їх заміщення.
Серед замісників І роду окреме місце займають галогени, які хоч і виявляють о- і n-орієнтуючу дію, але на відміну від інших електронодонорних замісників ускладнюють вступ нового замісника і сповільнюють швидкість реакції SE порівняно із бензеном. Така особливість галогенів поснюється тим, що їх негативний індуктивний ефект за абсолютною величиною перебільшує позитивний мезомерний ефект | -I| > |+M|.
Подвійний о- і n-орієнтуючий вплив електронодонорних замісників приводить до утворення внаслідок реакцій SE суміші ізомерів, наприклад:
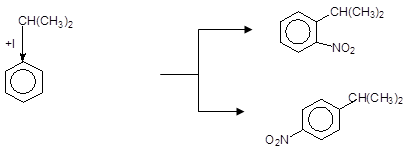 +Н2 О
+Н2 О
+ HO-NO2 о-Нітрокумол
+ H2O
Кумол
n-Нітрокумол
Замісники ІІ роду (електроноакцепторні) – це метаорієнтанти, які знижують електронну густину бензенового кільця і зменшують швидкість реакцій електрофільного заміщення. Їх називають дезактивуючими замісниками (табл. 2).
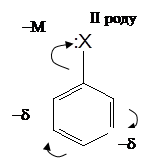
Замісниками ІІ роду є атоми і атомні групи, які відтягують p-електронну хмару бензенового кільця на себе завдяки негативному мезомерному (-М) чи негативному індукційному (-І) ефекту. Тому електронна густина на бензеновому кільці зменшується і внаслідок її перерозподілу лишається дуже незначний за величиною частковий негативний заряд (d-) на атомах карбону в мета-положеннях. Отже, замісники ІІ роду зменшують реакційну здатність кільця в реакціях SE, однак напрямлюють нові електрофільні групи у мета-положення, хоч реакції SE проходять дуже повільно.
Таблиця 2 – Вплив замісників на реакційну здатність та напрямок реакцій електрофільного заміщення в ароматичному кільці
| Замісник | Тип електрон–ного ефекту | Вплив на реакційну здатність* | Переважна орієнтуюча дія |
| Замісники І роду | |||
| -NH2, -NHR, -NR2, OH- | +M >> -I | + + + | o-, n- |
| -O– | +M, +I | + + + | o-,n- |
| -NHCOCH3, -OCH3, (-OR) | +M > -I | + + | o-, n- |
| -CH3, -CnH2n+1 | +I | + | o-, n- |
| -C6H5, -CH=CH2, -CºCH | +M > -I | + | o-, n- |
| -F, -Cl, -Br, -I | +M < -I | - | o-, n- |
| Замісники ІІ роду | |||
| -CN, -CH=O, -COR, -COOH, -COOR, -SO3H | -I, -M | - - | м- |
| -NR3+, -CF3, -CCl3 | -I | - - - | м- |
| -NO2, -N2+ | -I, -M | - - - | |
| * Активують сильно ( + + +), помірно ( + +) , слабо (+); дезактивують сильно ( - - -), помірно ( - - ), слабо ( - ). | |||
Наприклад, швидкість реакції нітрування нітробензену в 10000 разів менша, ніж швидкість нітрування самого бензену:
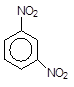 t0
t0
+ HO-NO2 ------- + H2O.