Реферат: Начала термодинамики
Количество тепла, полученное каждой из фаз, можно представить в виде:
![]() ,
, ![]() (2.43)
(2.43)
Здесь введены обозначения ![]() – количество тепла, полученное от подсистемы I подсистемой II ( и наоборот),
– количество тепла, полученное от подсистемы I подсистемой II ( и наоборот), ![]() – количество тепла, полученное подсистемами из внешней среды.
– количество тепла, полученное подсистемами из внешней среды.
Учитывая баланс теплоты:
![]() ,
,
см. 10 лист
![]() (2.44)
(2.44)
или
![]() (2.45)
(2.45)
Учитывая (2.9), запишем:
![]() ,
, ![]() (2.46)
(2.46)
Первая часть (2.46) характеризует теплообмен с внешней средой, а вторая создается за счет необратимого перехода тепла внутри системы. В соответствии с (2.10б) приращения энтропии всегда положительно. Прирост энтропии может быть равен нулю только после установления теплового равновесия:
![]()
Сделаем важное замечание о невозможности уменьшения энтропии в части закрытой системы при условии ее роста в системе в целом. То есть, ситуация, при которой
di SI > 0 и di SII < 0, d(SI + SII ) >0
физически нереализуема! Поэтому можно утверждать, что уменьшение энтропии в отдельной части системы, компенсируемое ее достаточным возрастанием в другой части системы является запрещенным процессом.
Отсюда следует, что в любом макроскопическом участке термодинамической системы приращение энтропии, обусловленное течением необратимых процессов, является положительным.
Такую формулировку второго начала термодинамики иногда называют “локальной” формулировкой. Ее основное значение состоит в том, что она позволяет провести более глубокий анализ необратимых процессов.
Обоснование “локальной” формулировки II-го начала возможно на основе методов статистической механики.
В дальнейшем анализе будет полезна производная от энтропии по времени:
![]() (2.47)
(2.47)
Таким образом, направление потока тепла определяется знаком функции состояния (1/ТI – 1/ТII ).
Найдем прирост энтропии в открытых системах. Вначале пренебрежем химическими реакциями. Из уравнения (2.6) для открытых систем и второго начала термодинамики получим:
![]()
![]() (2.48)
(2.48)
Применим это уравнение к закрытой системе, состоящей из двух открытых фаз I и II. Тогда для полного изменения энтропии системы можно записать:
![]()
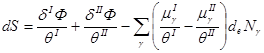 (2.49)
(2.49)
Разделим суммарный поток энергии на следующие составляющие:
![]()
![]() (2.50)
(2.50)
Здесь ![]() – количество тепла, получаемого от внешней среды, δI i Ф и δII i Ф – потоки энергии, поступающие от фазы II в фазу I и наоборот.
– количество тепла, получаемого от внешней среды, δI i Ф и δII i Ф – потоки энергии, поступающие от фазы II в фазу I и наоборот.
Тогда (2.49) принимает вид:
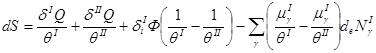 (2.51)
(2.51)
Разделяя в (2.51) изменение энтропии dS на поток энтропии de S и прирост энтропии внутри системы di S и учитывая (2.9), запишем:
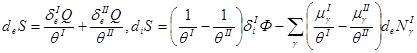 (2.52).
(2.52).
Прирост энтропии di S обусловлен переносом тепла и вещества между двумя фазами системы (подсистемами).
Для приращения энтропии в единицу времени можно записать:
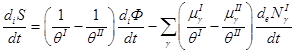 ≥0 (2.53)
≥0 (2.53)
Таким образом, скорость приращения энтропии представляет собой некоторую линейную функцию скоростей необратимых процессов.
Обобщим полученные результаты на непрерывные системы, в которых аддитивные параметры состояния являются не только функциями времени, но и непрерывными функциями пространственных координат. Такие системы иногда называют непрерывными системами.
Так, закон сохранения массы для непрерывной системы принимает вид:
![]() (2.54)
(2.54)
Здесь ![]() – скорость движения …?. Если мы говорим о смеси, то:
– скорость движения …?. Если мы говорим о смеси, то:
![]() (2.55)
(2.55)
где ![]() – макроскопические скорости движения отдельных компонент смеси.
– макроскопические скорости движения отдельных компонент смеси.
Поток компонента γ смеси можно представить в виде суммы потока со средней массовой скоростью ![]() и “диффузионного” потока. Так,
и “диффузионного” потока. Так,
![]() (2.56)
(2.56)
Здесь ∆γ – скорость диффузии по отношению к ![]() . Причем,
. Причем, ![]() .
.