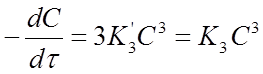Реферат: Скорость образования, расходования компонента и скорость реакции
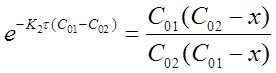
Откуда
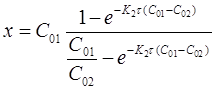
В частном случае, когда С01 = C02 = C 0 уравнение скорости односторонней реакции второго порядка примет вид (при v = 1):
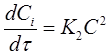 (17)
(17)
Если использовать значение х, то производная:
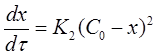 (18)
(18)
Разделим переменные в уравнениях (17) и (18), проинтегрируем первое в пределах от 0 до τи от С0 до С, второе от 0 до τи от 0 до х:
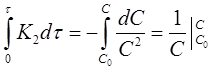
Откуда
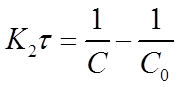 (19)
(19)
Если уравнение разрешить относительно К2 , то получим:
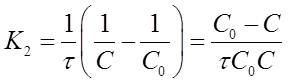
Интегрированиеуравнения (18)
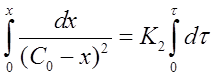
после решения для определения К2 дает формулу:
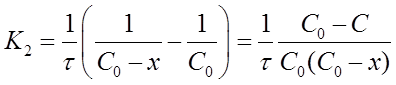
Константу скорости К2 определяют экспериментально. При этом используют уравнения (16) или (19) в виде:
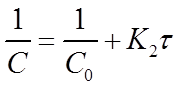
Приведенное уравнение в системе координат (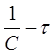 ) дает
) дает
прямую линию. Тангенс угла наклона этой линии, построенной по экспериментальным данным, равен константе скорости изучаемой реакции (рисунок 3).
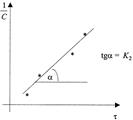
Рисунок 3 - Графическое определение константы скорости реакции второго порядка
1.4.3 Односторонние реакции 3го порядка
Это реакции вида:
3А → Продукты или А1 + А2 + А3 → Продукты.
Для скорости первой реакции справедливо соотношение:
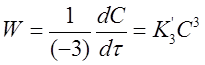
Откуда