Реферат: Скорость образования, расходования компонента и скорость реакции
Если концентрации исходных веществ СА1 =СА2 =СА3 =С в любой момент времени, то кинетическое уравнение скорости второй реакции имеет вид:
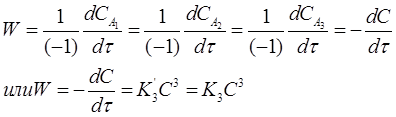 (20)
(20)
где K 3 = ʒ3 .
Разделим переменные в уравнении (20) и проинтегрируем его в пределах от 0 до τ и от С0 до С
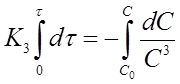
И получим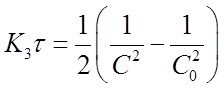
Если это равенство разрешить относительно К3 , то найдем формулу для вычисления константы скорости реакции третьего порядка:
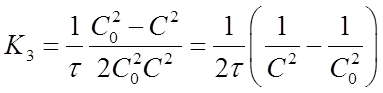 (21)
(21)
где С0 - начальная концентрация исходного вещества;
С - концентрация исходного вещества в момент времени г,
τ- время от начала реакции.
Константу скорости К3 определяют экспериментально. При этом используют уравнение (21) в виде:
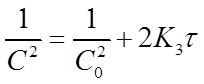
В системе координат (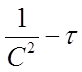 ) это уравнение представляетпрямую линию, угловой коэффициент которой (тангенс угла наклона) равен 2К3 (рисунок 4).
) это уравнение представляетпрямую линию, угловой коэффициент которой (тангенс угла наклона) равен 2К3 (рисунок 4).
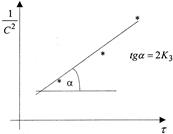
Рисунок 4 - Графическое определение константы скорости реакции третьего порядка
Константа скорости реакции 3го порядка имеет размерность: К3 , [1/время конц.2 ].
Если для реакции третьего порядка использовать величину х, то уравнение для скорости реакции приобретет вид:
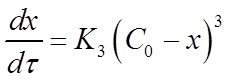
После разделения переменных и интегрирования уравнения в пределах от 0 до х и от 0 до τможно получить выражение для константы скорости реакции
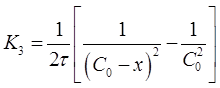
Существуют реакции, в которых скорость процесса не зависит от концентрации, так как она определяется некоторыми другими лимитирующими факторами, например, поглощением света при фотохимических реакциях или скоростью диффузии при поверхностных реакциях. Такие реакции считаются реакциями нулевого порядка. Для них
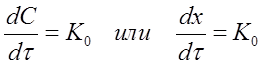 тогда
тогда 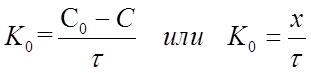
Размерность константы скорости реакции нулевого порядка К0 , [время-1 конц.].
1.5 Способы определения порядка реакции и константы скорости
1.5.1 Способ избыточных концентраций
Для реакции
v 1 А1 + v 2 A 2 →Продукты (22)
зависимость скорости от концентрации исходных веществ записывается уравнением:
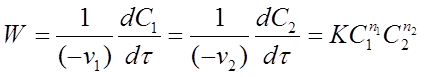 (23)
(23)