Реферат: Скорость образования, расходования компонента и скорость реакции
п1 и п2 - порядки реакции по веществам А1 и А2 ;
К - константа скорости реакции. Общий (суммарный) порядок реакции равен:
п = п1 + п2 (24)
Если реакция элементарная и формально простая и подчиняется кинетическому уравнению для элементарных реакций, то порядок реакции по веществам А1 и А2 равен их стехиометрическим коэффициентам в уравнении реакции, то есть
п1 = v 1 и п2 = v 2
тогда п = v 1 + v 2
Для определения порядка химической реакции сначала, по экспериментальным результатам изменения концентрации исходных веществ со временем, находят порядки реакции по веществам. Затем общий порядок реакции.
Для того чтобы скорость реакции зависела в явном виде только от концентрации одного из исходных веществ, обычно используют способ избыточных концентраций или метод изолирования Оствальда .
Он заключается в следующем.
Сначала проводят реакцию, когда концентрация исходного вещества А2 избыточна по сравнению с веществом А1 . При протекании реакции считают, что меняется только концентрация вещества А1 (обычно она в 10...1000 раз меньше концентрации остальных веществ), а концентрация вещества А2 практически постоянна и её можно ввести в постоянный коэффициент. При этом уравнение (23) примет вид:
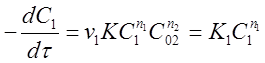 (25)
(25)
где 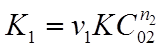 - константа скорости реакции по веществу А1 .
- константа скорости реакции по веществу А1 .
Затем проводят реакцию при избытке вещества А1 по сравнению с веществом А2 . Тогда уравнение (23) преобразуется к виду:
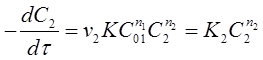 (26)
(26)
где ![]() - константа скорости реакции по веществу А2 .
- константа скорости реакции по веществу А2 .
Если удастся определить величины п1 и п2 , то можно будет найти общий порядок реакции по формуле (24) и константы скорости К1 и К2 , а затем константу скорости реакции по формуле:
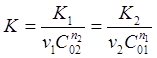
Иногда при проведении опытов используют метод, в котором концентрацию одного из исходных веществ изменяют, а концентрацию другого вещества оставляют постоянной.
Способы расчета порядка реакции по данному веществу подразделяются на дифференциальные и интегральные. Рассмотрим некоторые из них.
1.5.2 Дифференциальный метод (метод Вант-Гоффа)
При расчетах этим способом используют опытные данные зависимости скорости реакции от времени (кинетическое уравнение):
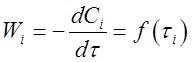
Из опытов, как правило, получают зависимость концентрацииданного компонента от времени (кинетическую кривую) Ci = f ( τi ) .
Поэтому для определения скорости реакции строят график в координатах
Ci - τi (рисунок 5). Скорость реакции в заданные моментывремени τi находят проведением касательных к экспериментальной кривойпо величине тангенса угла наклона этих касательных ( графическимдифференцированием):
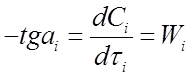
По уравнению (25) находят К1 , п1 или К2 , п2 по уравнению (26).
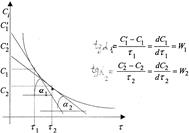
Рисунок 5 - Графическое определение скорости реакции по кинетической кривой