Реферат: Теория химико-технологических процессов
Влияние растворителя на скорость реакций SN 2 зависит от характера нуклеофильного реагента (нейтральная молекула или анион), который определяет тип переходного состояния и, в частности, степень разделения зарядов в нем по сравнению с исходными реагентами:
а) нуклеофильный реагент - нейтральная молекула.
![]()
Переходное состояние в такой реакции более полярно, чем исходные соединения. Увеличение полярности растворителя приводит к лучшей сольватации переходного состояния и, следовательно, к росту скорости реакции. Эти реакции ускоряются полярными растворителями, как протонными (спирты, карбоновые кислоты), так и апротонными (ацетон, диметилсульфоксид).
Реакции алкилирования аминов представляют собой типичный пример реакций SN 2 , в которых в качестве нуклеофила выступают нейтральные молекулы. Такие реакции гладко протекают и в спиртах.
б) нуклеофильный реагент – анион.
Переходное состояние этой реакции менее полярно, чем исходные реагенты, поскольку в нем отрицательный заряд распределяется между входящим нуклеофилом и уходящим галогеном. Изменения в сольватирующих свойствах растворителей в таких реакциях сказываются прежде всего на активности нуклеофила.
Полярные протонные растворители за счет водородных связей сольватируют нуклеофил-анион и понижают тем самым его энергию и реакционную способность.

Полярные апротонные растворители, многие из которых хорошо растворяют как соли, так и органические соединения, наиболее часто применяют в реакциях SN 2 . Молекулы полярных апротонных растворителей способны специфически сольватировать катионы и не могут сольватировать анионы. Многие реакции SN 2 проходят в таких растворителях на несколько порядков быстрее, чем в протонных.
В качестве примера нуклеофильного замещения с участием заряженного нуклеофила можно указать на реакции гидролиза и алкоголиза галогеналканов [4].
2.2.4. Влияние на протекание реакции строение уходящей частицы.
В ряду связей: C-F, C-Cl, C-Br, C-I реакционная способность в реакциях SN 2 возрастает, поскольку в этом ряду увеличиваются длина связи С-Х, ее поляризуемость, а также устойчивость уходящей группы - галогенид-иона.
Чем выше основность отщепляемой группы, тем труднее она отщепляется атакуемым нуклеофилом. Такие сильно основные группы, как, например, -OR, -OH, -NH2, связанные с углеродом через небольшие трудно поляризуемые атомы, в обычных условиях, как правило, не способны к замещению, однако в кислой среде они все же могут замещаться вследствие начальной протонизации, приводящей к образованию положительно заряженных частиц (а не нейтральных молекул), атакуемых нуклеофилом; в результате замещение менее основной группировки YH может идти легче, чем аниона Y- , хотя последний и является более сильным основанием.
Именно этим можно объяснить тот факт, что даже крайне прочно удерживаемый атом фтора в алкилфторидах может замещаться нуклеофильными реагентами в концентрированном растворе серной кислоты. И использование иодистого водорода для расщепления эфиров основано на том обстоятельстве, что ион I- представляет собой наиболее мощный нуклеофильный реагент, какой может быть получен в растворе сильной кислоты, которая, следовательно, необходима для реализации этой реакции.
Выше уже отмечалось, что перечень субстратов в реакциях SN 2 не ограничивается галогеналканами. В качестве реакционноспособных субстратов в них выступают, в частности, эфиры сульфокислот.
![]()
При этом группы RSO2 O- оказываются лучшими уходящими группами, поскольку являются сопряженными основаниями очень сильных алкил- или арилсульфоновых кислот.
По аналогичным причинам наиболее плохие уходящие группы - гидроксид-ион - ОН и амид-ион - NH2. Будучи сопряженными основаниями очень слабых кислот, эти ионы отличаются высокими энергиями образования и крайне редко выступают в качестве уходящих групп.
Ниже перечислены различные уходящие группы в ряду снижения легкости их отщепления (или снижения их «качества») [4]:
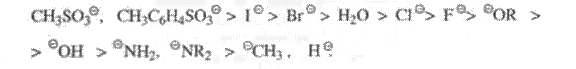
3. Обсуждение результатов
3.1. План кинетических экспериментов.
Анализ литературных данных, проведённых по учебной литературе, позволил предположить, что изучаемая реакция протекает, вероятнее всего, по механизму бимолекулярного нуклеофильного замещения (SN 2 ).
Схема механизма реакции:
![]()
Кинетическое уравнение для данного механизма:
![]() (3.1)
(3.1)
Оно включает неизмеряемую концентрацию переходного состояния С X - . Из схемы механизма реакции видно:
![]() (3.2)
(3.2)
Воспользовавшись принципом стационарности Боденштейна – Семёнова [3], в соответствии с которым в установившемся режиме:
![]() (3.3)
(3.3)
Отсюда получаем:
![]() (3.4)
(3.4)