Реферат: Теория химико-технологических процессов
![]() (3.5)
(3.5)
При подстановке этого выражения в уравнение (3.1) получим кинетическое уравнение для механизма SN 2 :
![]() (3.6)
(3.6)
Уравнение (3.6) включает 3 константы скорости: k1 и k2 – константы скоростей первой и второй реакции, и k-1 – константу скорости реакции распада промежуточной частицы на первой стадии реакции. При экспериментальном исследовании реакции необходимо решить вопрос о вкладе процесса распада промежуточного комплекса. Если эта реакция вносит существенный вклад в процесс, то кинетическая модель реакции будет представлена уравнением (3.6). Если же вклад обратной реакции мал, т.е. r-1 << r2 , уравнение (3.6) значительно упрощается, т.к. в знаменателе можно пренебречь слагаемыми k-1 , что приводит уравнение к виду (3.7):
![]() (3.7)
(3.7)
Таким образом, формируется план эксперимента, в котором необходимо предусмотреть опыты по выявлению вклада обратной реакции, чувствительности скорости реакции к изменению реакции концентрации каждого реагента, изучение влияния температуры на скорость реакции. В план эксперимента включены также опыты для проверки адекватности полученной модели.
Для рассматриваемой реакции можно предложить следующий план эксперимента:
Таблица 3.1. План эксперимента.
| Номер опыта | Начальные концентрации, моль/л | Темпера-тура, ºC | СZ , моль/л | СY , моль/л | Назначение опыта | ||
| CA,O | CY,O ключ. компонент | CZ,O | |||||
| 1 | 1,0 | 0,5 | 0 | 80 | 0,4 | 0,1 | Базовый опыт |
| 2 | 0,9 | 0,5 | 0 | 80 | 0,4 | 0,1 | Влияние концентрации компонента A на скорость реакции |
| 3 | 1,0 | 0,4 | 0 | 80 | 0,32 | 0,08 | Влияние концентрации компонента Y на скорость реакции |
| 4 | 1,0 | 0,5 | 0,2 | 80 | 0,6 | 0,1 | Вклад обратной реакции |
| 5 | 1,0 | 0,5 | 0 | 80 | 0,4 | 0,1 | Опыты на воспроизводимость |
| 6 | 1,0 | 0,5 | 0 | 80 | 0,4 | 0,1 | |
| 7 | 1,0 | 0,5 | 0 | 80 | 0,4 | 0,1 | Изучение влияния температуры на скорость реакции |
| 8 | 1,0 | 0,5 | 0 | 90 | 0,4 | 0,1 | |
| 9 | 1,0 | 0,5 | 0 | 100 | 0,4 | 0,1 | |
| 10 | 0,95 | 0,4 | 0,125 | 110 | 0,445 | 0,08 | Проверка адекватности |
3.2. Анализ первичных кинетических кривых.
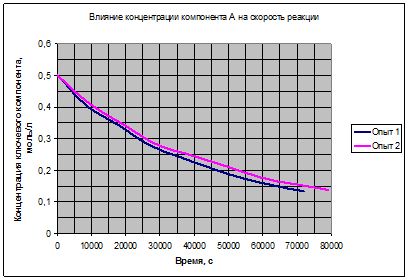
Рис. 3.1. Влияние компонента Aна скорость реакции.
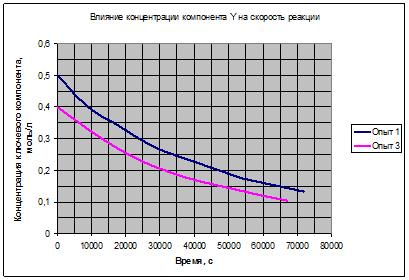
Рис. 3.2. Влияние концентрации Yна скорость реакции.
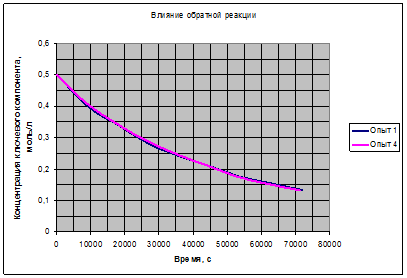
Рис. 3.3. Вклад обратной реакции.
3.3. Расчёт параметров кинетической модели.
Полученные зависимости на рис. 3.1, 3.2, 3.3 подтверждают возможность выбора для расчёта уравнения (3.7). Таким образом, можно считать основной гипотезой кинетической модели данной реакции выражение (3.7):
![]() (3.7)
(3.7)
Поиск констант можно осуществить интегральным и дифференциальными методами обработки результатов [?]. Воспользуемся интегральным методом, суть которого сводиться к поиску констант для интегрального решения уравнения. Для уравнения (3.7) интегральное решение имеет вид (3.8) [2]:
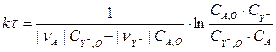 (3.8)
(3.8)
Где νA , νY - - стехиометрический коэффициент для вещества Aи Y- соответственно. А т.к. в стехиометрическом уравнении реакции νA = 1, νY - = 1, отсюда выражение (3.8) принимает следующий вид:
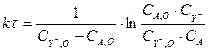 (3.9)
(3.9)
Где CA , O , С Y -, O – начальная концентрация вещества Aи Y- соответственно. Т.к. в уравнение (3.9) входит не определяемая в опыте текущая концентрация CA , её необходимо выразить через измеряемые концентрации CA , O , С Y -, O , С Y - , это возможно из уравнения материального баланса:
![]() (3.10)
(3.10)
Подставляя это выражение в уравнение (3.9), получим:
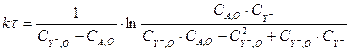 (3.11)
(3.11)
Для отыскания констант воспользуемся линейным методом наименьших квадратов [?]. Используя метод функциональных шкал, можно провести линеаризацию уравнения (3.11). Для этого положим:
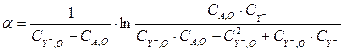 (3.12)
(3.12)
Тогда зависимость (3.11) запишется в виде линейной функции:
![]() (3.13)
(3.13)
3.3.1. Расчёт кинетической модели базового опыта.
При температуре t=80ºС, СA, O =1,0 моль/л, СY -, O =0,5 моль/л, τ1 = 9000, τ2 = 18000, …, τ8 =72000 были получены такие данные:
Таблица 3.2. Результаты базового опыта, приведённые для линейной функции (3.11).
| i | τi | 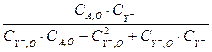 | αi | |
| 1 | 9000 | 0,9 | 0,888889 | 0,235566 |
| 2 | 18000 | 0,841 | 0,810939 | 0,419124 |
| 3 | 27000 | 0,78 | 0,717949 | 0,662714 |
| 4 | 36000 | 0,741 | 0,650472 | 0,860113 |
| 5 | 45000 | 0,707 | 0,585573 | 1,070329 |
| 6 | 54000 | 0,674 | 0,51632 | 1,322055 |
| 7 | 63000 | 0,653 | 0,468606 | 1,515984 |
| 8 | 72000 | 0,633 | 0,420221 | 1,733948 |
Для функции (3.13) можно оценить коэффициент kпо формуле [1]:
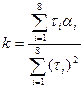 (3.14)
(3.14)