Учебное пособие: Изучение некоторых вопросов термодинамики
Из (6.10) и (6.11) следует:
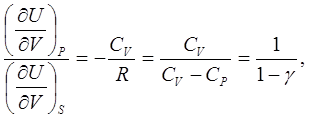
откуда
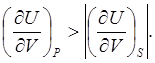 (6.12)
(6.12)
Объяснение причин различия значений этих величин должно быть подобно объяснению различия величин (6.8). Только в полученном выражении изменения объёма системы и её внутренней энергии при адиабатическом процессе имеют противоположные знаки, а при изобарическом – одинаковые.
ВЫВОД НЕКОТОРЫХ ПОЛЕЗНЫХ ТЕРМОДИНАМИЧЕСКИХ СООТНОШЕНИЙ.
1. Найдём разность теплоёмкостей СР и СV .
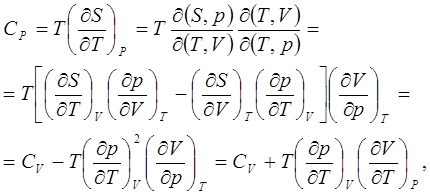
откуда
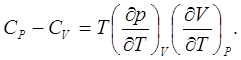 (7.1)
(7.1)
Отметим, что поскольку соответствующие частные производные в выражении (7.1) имеют положительные знаки, то при температурах выше абсолютного нуля СР > CV , а при температурах, близких к абсолютному нулю
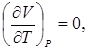
поэтому СР = С V , и так как при тех же температурах
![]()
то СР =С V =0.
2. Найдём связь между изменениями давления и энтропии при постоянном значении внутренней энергии системы
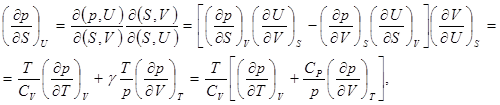 (7.2)
(7.2)
где использованы соотношения (2.7), (2.12), (2.17) и значения соответствующих частных производных от внутренней энергии. Нетрудно заметить, что для газов, при постоянном значении внутренней энергии, увеличение давления сопровождается уменьшением энтропии. Это и понятно, так как энтропия связана с вероятностью, а при увеличении давления уменьшается вероятность состояния системы.
3. Найдём связь между изменениями отдельных параметров системы при постоянном значении внутренней энергии.
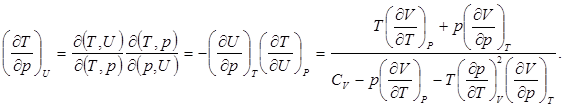 (7.3)
(7.3)
В случае идеального газа имеем:
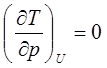 (7.4)
(7.4)
Этого и следовало ожидать, поскольку внутренняя энергия идеального газа зависит от температуры. Поэтому условию U=const соответствует T=const. Для реальных газов условие (7.4) не выполняется.
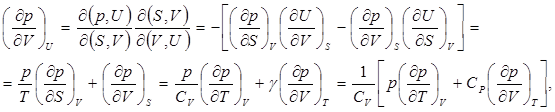 (7.5)
(7.5)
|
Гч /-• ^ .6 |
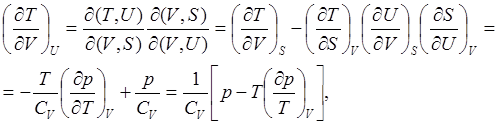 (7.6)
(7.6)
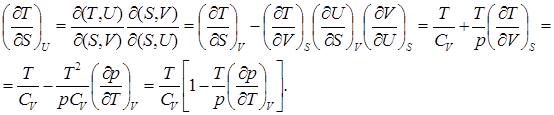 (7.7)
(7.7)
Нетрудно убедиться, что для идеального газа
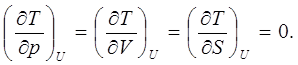 (7.8)
(7.8)
Найдём связь между изменениями отдельных параметров системы и её теплосодержанием.