Учебное пособие: Основы термодинамики
2.4. Работа расширения.
Пусть наша система характеризуется только одним внешним параметром объемом V. Давление Р характеризует взаимодействие системы с внешней средой и измеряется силой, отнесенной к единице поверхности. Если система находится в равновесии, то давление одинаково во всех частях системы и равняется внешнему давлению. Тогда работа изменения объема системы:
![]()
![]()
![]() ,
, ![]() ,
, ![]() - зависит от р=р (V ).
- зависит от р=р (V ).
V = Const , то dV = 0, dA =0, то A =0, т.е. ΔU = ![]() , в этом случае тепловой эффект
, в этом случае тепловой эффект ![]() равен изменению функции состояния.
равен изменению функции состояния.
p = Const, то ![]() ; T = Const, то
; T = Const, то ![]() . В этом случае необходимо знать уравнение состояния системы
. В этом случае необходимо знать уравнение состояния системы ![]() .
.
Если система - идеальный газ, то ![]() , поскольку pV = nRT , А
, поскольку pV = nRT , А![]() в связи с тем, что при T = const p 1 V 1 = p 2 V 2.
в связи с тем, что при T = const p 1 V 1 = p 2 V 2.
R = 0,082![]() Это стоит запомнить.
Это стоит запомнить.
Кроме того, при Т = Const для идеального газа U = Const , dU = 0 , A = Q , т.е. все тепло, полученное идеальным газом, перешло в работу.
Для адиабатического процесса dQ = 0 (Q = 0 ), dU = - dA , - ΔU = A т.е. положительная работа совершается за счет уменьшения U .
2.5. Теплота и теплоемкость.
Теплоемкостью системы называется отношение количества тепла, сообщенного системе в каком-либо процессе, к соответствующему изменению температуры:
![]() 1 кал = 4,1840 дж, 1 дж = 107 эрг (СИ)
1 кал = 4,1840 дж, 1 дж = 107 эрг (СИ)
Поскольку Q -функция процесса, то ![]() , а
, а ![]() ,
, ![]()
![]() .
.
Связь между Ср и С v для любых систем найдем следующим образом.
dQ = dU + pdV I закон .
Выберем в качестве независимых переменных объем и температуру, тогда внутренняя энергия:
![]() и
и ![]() ,
,
а ![]()
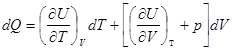 .
.
Разделим правую и левую части на dT , получим:
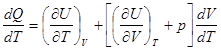 .
.
Отношение ![]() есть отношение приращений независимых переменных, то есть величина неопределенная, и чтобы снять неопределенность, необходимо указать характер процесса. Пусть процесс изохорный.
есть отношение приращений независимых переменных, то есть величина неопределенная, и чтобы снять неопределенность, необходимо указать характер процесса. Пусть процесс изохорный.
V = Const ![]() и
и ![]() =СV .
=СV .
Отсюда 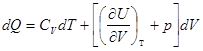 .
.
Далее при p = Const 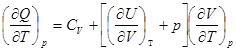 = Ср
= Ср
И для любых систем 
![]() .
.
Для идеальных газов ![]() (Строго докажем при II законе).
(Строго докажем при II законе).
А поскольку pV = RT , то ![]()
![]() .
.
Заметим, что ![]() – работа, которую совершает система, преодолевая внутренние силы сцепления. Производная
– работа, которую совершает система, преодолевая внутренние силы сцепления. Производная ![]() имеет размерность давления и называется внутренним давлением .
имеет размерность давления и называется внутренним давлением .
2.6. Уравнение адиабаты идеального газа.