Учебное пособие: Основы термодинамики
Для идеального газа dU = CV dT , следовательно, dQ = Cv dT + pdV , и если процесс адиабатический dQ = 0, то
![]() ,
,
![]() , где
, где ![]() .
.
CV и Cp для идеального газа не зависят от температуры:
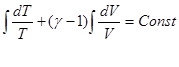
![]() ,
,
![]()
Поскольку ![]() , то
, то ![]() Уравнение Пуассона
Уравнение Пуассона
Для газов величину γ можно определить, измеряя скорость звука в газе:
![]() – скорость звука в газе, имеющего мольную массу М.
– скорость звука в газе, имеющего мольную массу М.
Глава 3. Термохимия.
3.1 Энтальпия.
Если система характеризуется только одним внешним параметром V , т.е. может совершаться только работа расширения, тогда первый закон может быть записан в виде: ![]() .
.
Если ![]() т.е. тепловой процесс эффекта равен изменению функции состояния. Найдем такую функцию состояния, изменение которой равно тепловому эффекту при постоянном давлении. Для этого выражение для I закона необходимо преобразовать так, чтобы давление находилось под знаком дифференциала. Обратим внимание, что
т.е. тепловой процесс эффекта равен изменению функции состояния. Найдем такую функцию состояния, изменение которой равно тепловому эффекту при постоянном давлении. Для этого выражение для I закона необходимо преобразовать так, чтобы давление находилось под знаком дифференциала. Обратим внимание, что
d (pV ) = pdV + Vdp и pdV = = d (pV ) – Vdp , а подстановка в выражение для I закона дает:
dQ = dU + d (pV ) – Vdp = d (U + pV ) – Vdp = dH - Vdp
| H ≡ U + pV | – функция состояния называется энтальпией . |
![]() . При
. При ![]()
![]() .
.
Выберем в качестве независимых переменных Т и р , тогда:
![]()
![]()


![]() – отношение приращения независимых переменных является неопределенной величиной, чтобы избежать этого нужно указать конкретный процесс. Если p = Const , то
– отношение приращения независимых переменных является неопределенной величиной, чтобы избежать этого нужно указать конкретный процесс. Если p = Const , то ![]()
Очевидно, есть определенная симметрия между U и H :
![]()
3.2. Теплоты химических реакций. Закон Гесса.
При химических реакциях происходит изменение U , посколькуU продуктовреакцииотличается от U исходных веществ. Пусть U 2 – внутренняя энергия продуктов реакции, U 1 – внутренняя энергия исходных веществ, ΔU = U 2 – U 1 - изменение U в результате химического процесса. Аналогично для энтальпии. Изучением теплот химических реакций занимается термохимия.
Q - теплота химической реакции, зависит от способа проведения химической реакции. ![]()
![]()
![]() ,
,
![]()
![]()
![]() .
.
Т.о., в этих случаях Q равна изменению функции состояния и поэтому не зависит от пути процесса, а лишь от начального и конечного состояния.
Закон Гесса (1836). Если из данных исходных веществ можно получить заданные конечные продукты разными путями, то суммарная теплота процесса (при ![]() или при
или при ![]() ) на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т.е. не зависит от пути перехода от исходных вществ к продуктам реакции.
) на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т.е. не зависит от пути перехода от исходных вществ к продуктам реакции.