Учебное пособие: Основы термодинамики
Тепло не может само по себе перейти от системы с меньшей температурой к системе с большей температурой (Клаузиус ).
Невозможно получать работу, только охлаждая отдельное тело ниже температуры самой холодной части окружающей среды (Кельвин ).
4.3. Обратимые и необратимые процессы.
Процесс называется равновесным , если в прямом и обратном направлении проходит через одни и те же состояния бесконечно близкие к равновесию. Работа равновесного процесса имеет максимальную величину по сравнению с неравновесными процессами и называется максимальной работой .
Если равновесный процесс протекает в прямом, а затем в обратном направлении так, что не только система, но и окружающая среда возвращается в исходное состояние и в результате процесса не остается никаких изменений во всех участвовавших в процессе телах, то процесс называется обратимым .
Обратимый процесс – такая же абстракция, что и идеальный газ.
Крайние случаи необратимых процессов: переход энергии от горячего тела к холодному в форме теплоты при конечной разнице температур, переход механической работы в теплоту при трении, расширение газа в пустоту, диффузия, взрывные процессы, растворение в ненасыщенном растворе.
Эти необратимые процессы идут самопроизвольно без воздействия извне и приближают систему к равновесию.
4.4. Изменение энтропии в различных процессах.
![]() , причем знак = относится к обратимым процессам, а знак > к необратимым.
, причем знак = относится к обратимым процессам, а знак > к необратимым.
Если требуется вычислить энтропию необратимого процесса необходимо провести обратимый процесс между теми же самыми конечным и начальным состоянием (используем тот факт, что энтропия – функция состояния).
а) Изотермический процесс:
![]() , Q – часто это скрытая теплота фазовых переходов.
, Q – часто это скрытая теплота фазовых переходов.
б) Изменение температуры при ![]()
![]() :
:
![]()
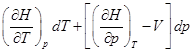 , следовательно
, следовательно  , т.к.
, т.к. ![]()
Энтропия необратимого процесса: ![]()
Теплота конденсации при 298 К равна – 10519 кал, ![]()
Ответ, очевидно, неверен, поскольку процесс необратимый. Проведем его обратимо: ![]()
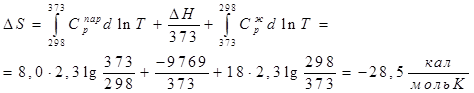
(-9769 – теплота конденсации при 373 К )
![]()
Заметим, что действительно ![]() меньше, чем
меньше, чем ![]() .
.
4.5. Закон Джоуля
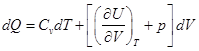 ,
,
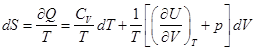 – это полный дифференциал, следовательно
– это полный дифференциал, следовательно 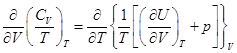 .
.
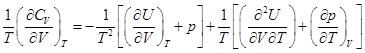 ,
, ![]()
![]()
![]() .
.
Для идеального газа ![]()
![]() и
и ![]() ,
,
Для любых систем ![]() ,
,