Лабораторная работа: Химические методы анализа
Навеска соли будет 1,3274 г.
Масса тигеля с веществом после высушивания
1 е взвешивание 11,7629
2 е взвешивание 11,7624
3 е взвешивание 11,7622
Из результатов взвешивания видно, что второе и третье взвешивание достаточно близки, поэтому отбрасывают первый результат и берут средний из двух последующих:
(11,7624+11,7622) / 2 = 11,7623
По разности массы тигля с веществом до высущивания и после находят массу кристаллизационной воды:
11,9846 - 11,7623 = 0,2223 г.
Процентное содержание кристаллизационной воды находят из пропорции:
В 1,3272 г. навески содержится 0,2223 г. H2 O
в 100 г . Х2 H2 O
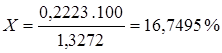
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Метод нейтрализации
В титриметрическом (объемном) анализе раствор с точно известной концентрацией (титрованный или стандартный раствор) помещают в бюретку и по каплям приливают к исследуемому раствору с известным объемом, помещённый в коническую колбу и постоянно перемешивают. По изменению окраски индикатора или другим признакам определяют эквивалентный объем, затраченный на реакцию и подставляя его значение (V) в расчетные формулы определяют количество исследуемого вещества.
Метод нейтрализации или кислотно-основного титрования основан на реакции:
H+ + OH- = H2 O
и позволяет определять концентрации кислот, щелочей, гидролизирующихся солей и т.д.
Лабораторная работа №10
Определение процентного содержания кислот
Работа проводится в следующей последовательности.
1. Приготовление 250 мл 0,1 нормального стандартного раствора щавелевой кислоты.
2. Приготовление 250 мл 0,1 нормального раствора щелочи из 4%-ного раствора.
3. Определение точной концентрации приготовленной щелочи.
4. Определение процентного содержания контрольного раствора кислоты.