Дипломная работа: Качественный анализ (кислотно-основная классификация)
Катион Сг3+ с гидрофосфатом натрия образует осадок фосфата хрома СгРО4 зеленого цвета, растворимый в кислотах и щелочах; с арсенитами и арсенатами дает малорастворимые осадки арсенита CrAsO3 и арсената CrAsO4 соответственно.
Аналитические реакции катионов V аналитической группы по кислотно-основной классификации: Mg2+ , Mn2+ , Fez + , Fe3+ , Bi3+ , Sb3+ , Sb5+
Групповой реагент - гидроксид натрия или калия
Аналитические реакции катионов магния Mg2+
1. Реакция с щелочами и аммиаком: Mg2+ + 2 ОН- —> Mg(OH)2 (белый аморфный)
Mg2 + + 2 NHr H2 O = Mg(OH)2 + 2 NH4 +
Осадок не растворяется в щелочах, растворяется в НС1, H2 SO4 , CH3 COOH: Mg(OH)2 + 2 Н+ -► Mg2+ + 2 Н2 О
2. Реакция с гидрофосфатом натрия Na2 HPO4 (фармакопейная).
Реакцию проводят в аммиачном буфере:
Mg2+ + НРО4 2 - + NH3 -- NH4 MgPO4 | (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4 . Избыток NH4 мешает выпадению NH4 MgPO4 . Осадок NH4 MgPO4 растворяется в минеральных кислотах и в уксусной кислоте:
NH4 MgPO4 + 3 НС1 - Н3 РО4 + MgCl2 + NH4 C1
NH4 MgPO4 + 2 CHjCOOH= NH4 H2 PO4 + (CH3 COO)2 Mg
Проведению реакции мешают катионы Li+ , Ca2+ , Sr2 , Ba2+ и др.
3. Реакция с магнезоном I - п - нитробензолазорезорцином.
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами М^2+ ,комплекс синего цвета, сорбирующийся на осадке Mg(OH)2 :
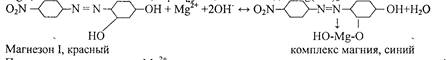
При малых концентрациях Mg2+ осадок не выделяется, а раствор окрашивается в синий цвет. Проведению реакции мешают Cd2+ , Sn2+ , Cr3+ , Fe2+ , Co2+ , Ni2+ .
4.Реакция с 8- оксихинолином.
Реакцию проводят в аммиачной среде при рН = 8—13 (при нагревании).
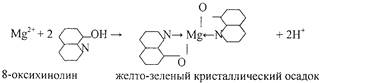
Осадок растворим в минеральных кислотах и в уксусной кислоте. Проведению реакции мешают катионы, также образующие комплексы с 8 -оксихинолином (Cu2+ , Zn2+ . Cd2+ , Fe3+ и др.).
5. Реакция с хинализарином.
Реакцию проводят в щелочной среде. Образуется синий осадок комплексного соединения – хинализарината магния состава MgL(OH), где НL – условное обозначение молекулы хинализарина:
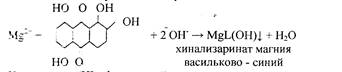
При небольшом содержании катионов Mg2+ в растворе осадок не выпадает, а раствор окрашивается в цвет. Проведению реакций мешают катионы алюминия.
6. Реакция с растворимыми карбонатами (Nа2 С03 ).
2 Mg2+ + 2 Nа2 С03 + Н2 О = (МgОН)2 С0з (белый аморфный) +4 Nа + СО2 . Осадок (МgОН)2 С0з ,растворим в кислотах и в солях аммония.
7. Реакция с оксалатом аммония (NH4 )С2 О4 .
Mg2+ + (NH4 )С2 О4 = Mg С2 О4 (белый) + 2 NH4
8. Катионы Mg2+ с дифенилкарбазидом (С6 Н5 NHNH)2 С0 образуют комплекс красно— фиолетового цвета.
Аналитические реакции катиона марганца
Аквокомплексы [Мn(Н2 О)6 ]2+ марганца (II) окрашены в бледно — розовый цвет. Сильно разбавленные водные растворы солей марганца (и) практически бесцветны.