Дипломная работа: Качественный анализ (кислотно-основная классификация)
3.Реакция с сульфид - ионами (фармакопейная): Fe2+ + S2 - —> FeSJ. (черный) Осадок растворяется в разбавленных минеральных кислотах и в уксусной кислоте.
4.Реакция с диметилглиоксимом (реактив Чугаева). Предел обнаружения 0,4 мкг.
(CH3 CNOH)2 + Fe2+ + 2 NH4 OH ->■ [Fe(C4 H7 N2 O2 )2 ] + NH3 + 2 H2 O
реактив Чугаеварозово-красный комплекс
5.Окисление Fe2+ в FeJ + растворами KMnO4 , K2 Cr2 07 , HNO3
6.FeSO4 + 3 H2 SO4 + 2 HNO3 = 3 Fe2 (SO4 )3 + 4 H2 O + 2 NOT
До исчезновения бурой окраски, зависящей от образования нестойкого комплекса [Fe(NO)]SO4 .
Аналитические реакции катионов железа ( III ) Fe 3 +
Акво-ионы железа (III) [Fe(H2 O)6 ]3+ в водных растворах окрашены в желтый цвет и частично гидролизованы до растворимых гидроксоаквокомплексов [Fe(OH)n (H2 0)6 .n ]3 --, также окрашенных в желто - бурый цвет. Поэтому водные растворы солей железа (III) имеют желтую или красновато-бурую окраску.
1.Реакция с щелочами и аммиаком: Fe3+ + 3 ОН' —> Fe(OH)3 J. (красно - бурый) Осадок растворим в разбавленных кислотах: но не растворяется в насыщенном растворе NH4 CI (в отличие от белого осадка Fe(OH)2 ), а также в растворах щелочей.
2.Реакция с гексацианоферратом (II) калия - с ферроцианидом калия
3.(фармакопейная).
Катионы Fe3+ при pH=2-3 реагируют с ферроцианидом калия:
4 Fe3+ + 3 [Fe (CN)6 ]4 ' + ХН2 О — Fe4 [Fe (CN)6 ]3 -XH2 O
-берлинская лазурь- (темно-синий)
Проведению реакции мешают окислители и восстановители. Окислители окисляют ферроцианид до феррицианида, а восстановители восстанавливают Fe(III) до Fe(II). Осадок не растворяется в кислотах, разлагается при прибавлении раствора щелочи: Fe4 [Fe(CN)6 ]3 + 12 ОН- -> 4 Fe(OH)3 + 3 [Fe(CN)6 ]4 -
3.Реакция с тиоционат — ионами при рН~3 (фармакопейная).
Для подавления образования гидроксокомплексов, содержащих ОН- группы, реакцию проводят в кислой среде. Раствор окрашивается в красный цвет.
[Fe(H2 O)6 ]3+ + nNCS- = [Fe (NCS)n (H2 O)6 .J3 -n + nH2 O (где n=l,2,3,....6) Проведению реакции мешают: окислители, восстановители, ртуть(П)._фториды, тгодиды. фосфаты, цитраты, тартраты и др. Катионы Fe2+ не мешают. 4. Реакция с сульфосалициловой кислотой (фармакопейная).
FeJ + образует с сульфосалициловой кислотой окрашенные комплексы. В зависимости от рН среды и соотношения реагирующих компонентов состав и окраска комплексов могут быть различными. Так, при рН=2-2,5 доминируют комплексы красного цвета, при рН=4-8 - бурого и при р№=9-11,5 - желтого. Наиболее устойчив комплекс желтого цвета (соотношение концентрации Fe(III) и сульфосалйциловой кислоты = 1:3): Fe+3 L2 '= [FeL3 ]3 -
Где H2 L - условное обозначение молекулы сульфосалициловой кислоты, aL- -обозначение сульфосалицилат-аниона, образовавшегося из сульфосалициловой кислоты, при отщеплении двух протонов:
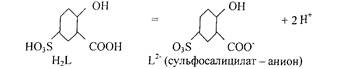
По-видимому, при рН=2-2,5 образующийся красный комплекс содержит железо (III) и Г2 - в мольном соотношении 1:1, при рН=4 - 8 бурый комплекс - в мольном соотношении 1:2.
5.Реакция с сульфид - ионами (фармакопейная): 2 Fe3+ + 3 S2 - -+ Fe2 S3 j (черный) Реакцию проводят в нейтральной или слабоаммиачной средах.
Осадок сульфида железа (III) растворяется в минеральных кислотах.
6.Гидрофосфат натрия Na2 HPO4 образует с Fe3+ бледно-желтый осадок FePO4 , растворимый в сильных кислотах, но нерастворимый в уксусной кислоте:
Fe3+ + 2 НРО4 2 - = FePO4 + Н2 РО4 \
Карбонаты щелочных металлов и аммония-образуют бурый осадок основных солей, которые при кипячении превращаются в гидроокись.
7.Другие реакции Fe3+ . Катионы Fe3+ при реакции с ферроном (7-иод-8-оксихинолин-5- еульфоновой кислотой) в кислой среде (р№=2,6) образуют комплексы зеленого цвета; при реакции с тайроном (1,2-диокси-3,5-дисульфобензолом) - комплексы синего цвета, изменяющие окраску на красную в щелочной среде; при реакции с купфероном красный осадок купфероната железа (III) и т.д.