Учебное пособие: Примеры решения задач по реакциям электролиза
m (Ag) - ?
m (Cu) - ?
m (Au) - ?
1) Все металлы, катионами которых образованы данные соли, находятся в ряду активности металлов «после водорода» в ряду активности металлов «после водорода», значит на катодах будет протекать реакция восстановления только металлов:
![]() Ag+ + 1
Ag+ + 1![]() Ag 0 ; n=1, M(Ag) = 108 г/моль
Ag 0 ; n=1, M(Ag) = 108 г/моль
![]() Cu+ + 2
Cu+ + 2![]() Cu0 ; n=2, M(Cu) = 64 г/моль
Cu0 ; n=2, M(Cu) = 64 г/моль
![]() Au+ + 3
Au+ + 3![]() Au 0 ; n=3, M(Au) = 197 г/моль
Au 0 ; n=3, M(Au) = 197 г/моль
2) По формуле объединенного закона электролиза:
m (в-ва) = ![]() вычисляем массы металлов:
вычисляем массы металлов:
m(Ag) = 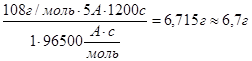
m(Cu) = 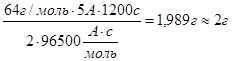
m(Au) = 
Ответ: m(Cu) = 2г , m (Ag) = 6,7г , m(Au) = 4г.
Задача № 2
Вычислить массу газа, выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 1,5А.
Решение
р-р H2SO4
F = 10мин = 600с
I = 1,5 A
F = 96 500 Кл/моль
m (O2) - ?
1) См. схему реакции электролиза и электронные полуреакции в примере №10 (часть IV). Электролиз раствора серый кислоты сводится к электролизу воды:
ί
2H2 O = O2 ↓ + 2H2 ↑ ;
на аноде выделяется кислород: 2H2 O- 4![]() = O2 ↑+ 4H+ ;
= O2 ↑+ 4H+ ;
значит n = 4
2) m(O2 ) = 
Ответ: m(O2 ) = 0,075г
Задача № 3